在全球视力受损原因中,角膜盲是仅次于白内障的第二大病因,其诱因繁多,包括感染、外伤、自身免疫疾病等[1]。目前角膜移植手术是治疗角膜盲唯一有效的方法[2],通过移植捐献者的供体角膜替换患者病变的角膜组织,以恢复患者视力,改善日常生活质量。角膜移植可以分为全层移植和成分移植,如角膜板层移植和内皮移植等[3-4]。由于角膜组织没有血管,处于免疫豁免状态,角膜移植的成功率位于各器官移植之首[5]。尽管角膜移植无需配型,但为了确保供体角膜的安全性和质量,眼库常规会对移植物传播的传染病进行严格的筛查。由于潜在的疾病传染风险,目前国际上大部分眼库指南都将乙肝表面抗原(HBsAg)阳性捐献者的角膜供体排除在外[6]。
乙型肝炎病毒(HBV)是一种嗜肝病毒,感染后主要存在于肝细胞内,引起肝细胞炎症、坏死、纤维化,是全球慢性肝病和肝细胞癌的主要病因[7]。同时,HBV还可以在肝外组织被检出,如肾脏、胰腺、泪液、房水等[8-10]。最新研究数据显示,中国有7 000多万乙肝病毒携带者[11]。乙肝三对半是该疾病常规的检测手段。HBsAg在乙肝三对半中检测阳性意味着往往提示机体中有完整的病毒颗粒存在。
角膜供体匮乏一直是中国角膜移植工作的重要限制因素。虽然政府做出了很大努力,人民群众的遗体捐赠意识逐步提高,人工角膜材料也逐步引进,但面对数量庞大的角膜病患者群体,中国仍存在非常大的角膜供体缺口。当前中国角膜库指南拒绝接受HBsAg血清阳性的供体,这可能导致潜在供体角膜的大量流失。尽管已有各种类型的人工角膜上市作为人源供体角膜的替代选项,但同种异体角膜适应症更广,排斥反应率更低,仍是首选的移植材料[12-13]。为了应对这样的缺口,台湾地区尝试将来自慢性HBV感染捐献者的角膜可以分配给同样患有慢性HBV或表现出HBV免疫力(HBV表面抗体[anti-HBs]>10 IU/mL)的受者[14]。在2019年黄一勋等人的报道中,所收集的28位病例尚未发生不良事件[15]。但他们并未探究HBV在角膜成分中的表达。
本研究旨在通过收集血清HBsAg阳性捐赠者的角膜,了解HBsAg在角膜中的表达和定位情况,为HBsAg阳性供体能否应用于临床提供理论依据。
材料与方法
组织来源
实验中使用的所有供体角膜均来自中南大学湘雅三医院眼库,收集时间为2019年12月至2021年3月。本研究经中南大学湘雅三医院伦理委员会批准(日期:2022年4月6日,编号:I 22067),捐赠者的家人被告知了研究目的,并签署了知情同意书。
血清学检测
捐献前抽取捐献者的血液送至湘雅三医院检验科进行血清HBsAg、HBV DNA滴度的检测,用HBsAg ELISA试剂盒(48T/96T,丽珠,珠海)检测这些捐献者的HBsAg阳性情况,使用PCR测定血中HBV DNA滴度。所有操作都严格按照制造商的说明进行。
角膜获取和实验分组
根据中国眼库的操作程序[16],取得6位捐献者的10个眼球。8例来源于HBsAg血清阳性供体,2例来源于HBsAg血清阴性供体。获取的眼球在林格氏液中进行常规清洗后,浸入5%聚维酮碘浸泡5分钟。在眼科手术显微镜下,使用无菌尖刀片及显微剪沿着角膜缘处360°环形剪下角膜组织。
受制于实际临床工作,角膜保存和分组根据收样时的条件决定。将取得的角膜组织放入装有相应保存液的无菌瓶中,贴上标签,储存在冰箱中,并记录每个角膜的保存时间和温度(表1)。
| 分组 | 保存方法 | 保存时间 | 数量 | HBsAg |
|---|---|---|---|---|
| A | 中期保存液 | <2周 | 4 | (+) |
| B | 甘油 | 1个月 | 2 | (+) |
| C | 甘油 | 1年 | 2 | (+) |
| D1 | 中期保存液 | <2周 | 1 | (-) |
| D2 | 甘油 | 1年 | 1 | (-) |
免疫荧光染色
将取得的供体角膜放入4%多聚甲醛固定液,4 ℃冰箱中浸泡24小时,石蜡包埋,石蜡切片机切成4 µm厚的切片,然后对切片进行脱蜡,并用EDTA抗原修复缓冲液(pH 8.0,G1206,Servicebo,中国武汉)提取抗原。乙型肝炎病毒表面单克隆抗体(1꞉25稀释,MA5-13059,Thermo Fisher Scientific,Rockford,IL,USA)在用血清封闭后在切片上孵育过夜。使用相同体积的磷酸盐缓冲盐水(Phosphate buffer saline,PBS)孵育阴性对照切片。加入二抗(GAlexa 488山羊抗小鼠IgG,GB25301,Servicebio,武汉,中国),以1꞉400稀释50分钟。使用DAPI(C1002,碧云天,上海,中国)进行细胞核染色,并用自体荧光淬灭剂(G122,Servicebio,武汉,中国)淬灭自体荧光5分钟。封片后在荧光显微镜(Zeiss激光共聚焦显微镜LSM880)下观察并捕获图像。
免疫荧光半定量及统计分析
使用ImageJ(https://imagej.nih.gov/ij/)进行切片荧光半定量分析。使用GraphPad 8.0(GraphPad Software Inc.,USA)制图。应用SPSS 25.0统计学软件进行统计学分析,由于检测得捐赠者血中HBV DNA滴度量级相差较大,故进行对数变换,使数据符合正态分布后再进行Pearson相关性分析。计量资料以均数±标准差(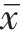
结 果
角膜分组
根据保存时间及方式的不同将角膜分为四组:A)4枚新鲜供体角膜储存在4 ℃的中期角膜保存液中(Alchimia,Ponte San Nicolo,Italy)<2周;B)2枚供体角膜在-20 ℃甘油中储存1月;C)2枚供体角膜在-20 ℃甘油中储存1年;D1)1枚供体角膜在4 ℃的中期角膜保存液中储存<2周;和D2)1枚供体角膜在-20 ℃的甘油中储存1年。
角膜不同层次间HBsAg的表达
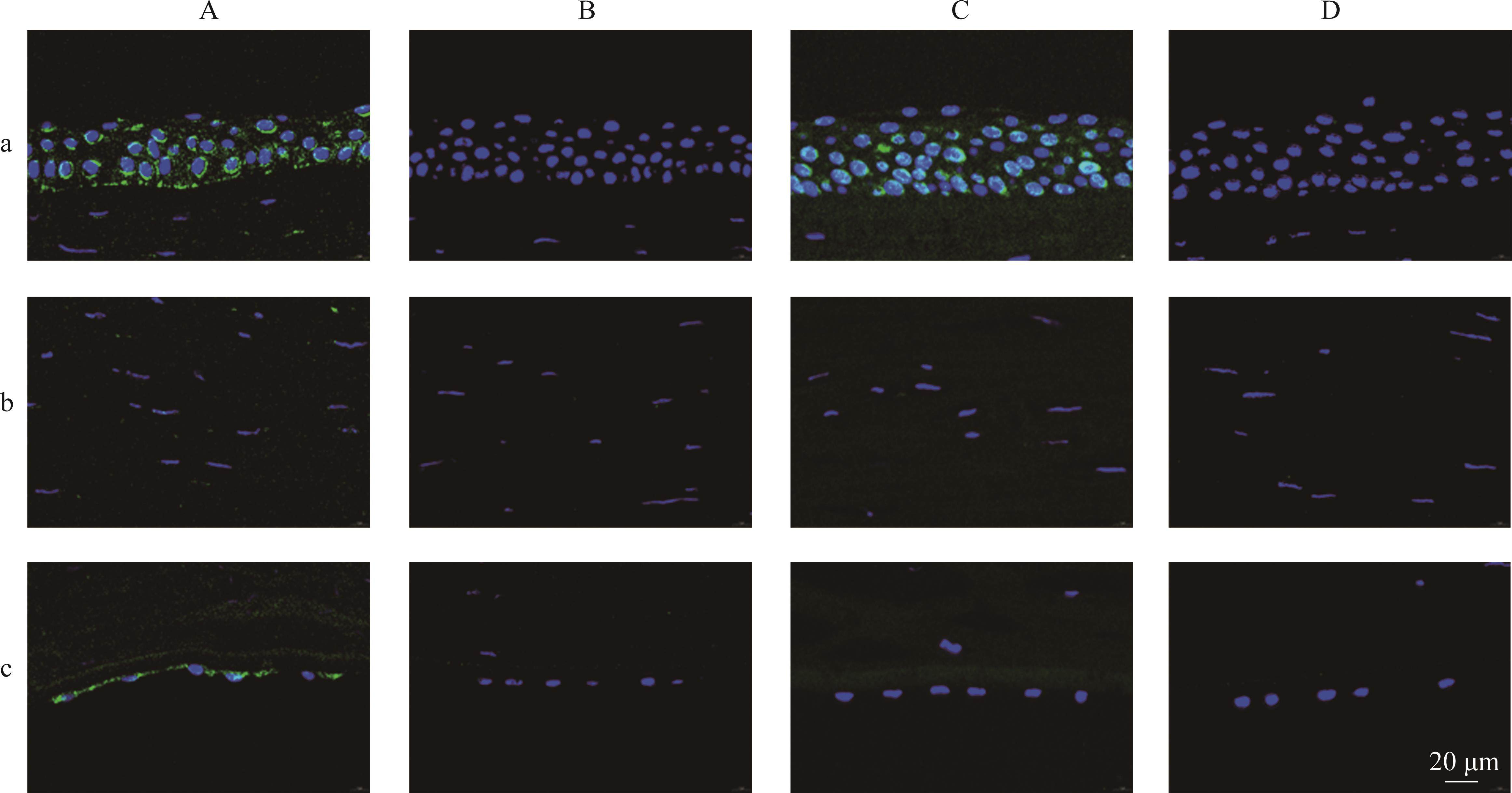
通过免疫荧光染色法检测HBsAg在各组供体角膜中的表达。我们的结果提示,来自HBsAg血清阳性捐献者的A组供体角膜4例有2例在上皮层和内皮层中观察到HBsAg的阳性染色。另外,甘油保存的C组供体角膜,仅在上皮层中观察到HBsAg阳性染色。其余A、B、C及D组的供体角膜,均没有观察到阳性HBsAg的表达信号(表2)。
| 角膜编号 | A1a | A1b | A2a | A2b | Ba | Bb | Ca | Cb | D1 | D2 |
|---|---|---|---|---|---|---|---|---|---|---|
| HBsAg表达 | ||||||||||
| 上皮层 | + | - | - | + | - | - | + | - | - | - |
| 内皮层 | + | - | - | - | - | - | - | - | - | - |
图1显示了HBsAg(绿色荧光)在各保存条件下角膜不同成分间的表达。在角膜上皮层中,新鲜的角膜组织和甘油保存一年的角膜组织部分检测出HBsAg,主要局限于蓝色信号(细胞核)周围(图1Aa、1Ca)。在角膜基质层中,不同保存条件下都没有检测到HBsAg(图 1Ab、1Bb、1Cb)。在角膜内皮层中,HBsAg的表达仅在新鲜角膜组织中检测到(图1Ac)。角膜内皮细胞中HBsAg的表达模式与上皮细胞类似,围绕于核周围,分布在胞浆中。而在甘油保存的角膜组织内皮细胞中未检测到HBsAg表达(图1Bc、1Cc)。
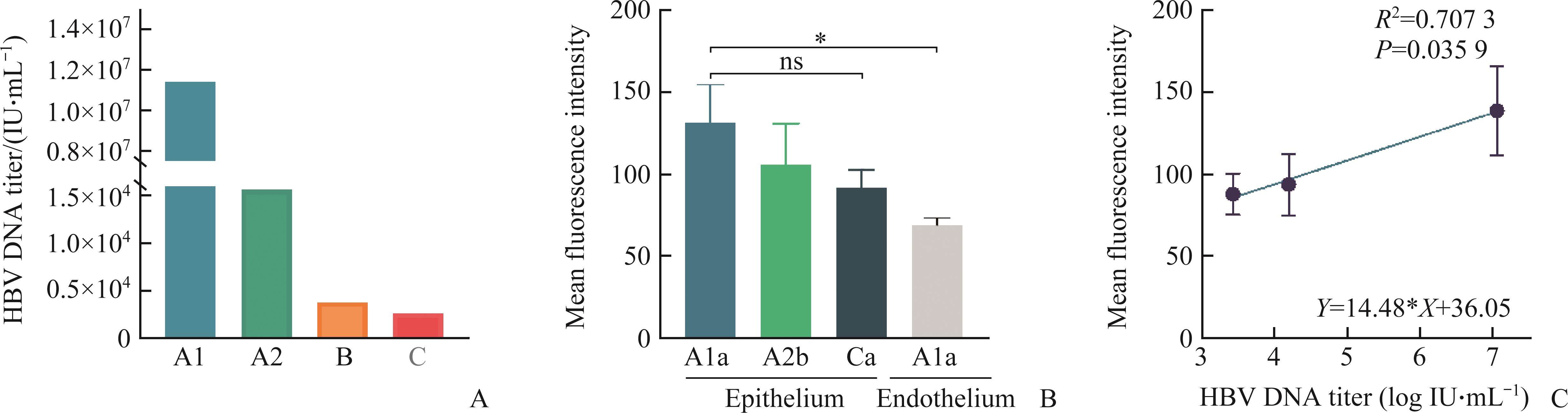
捐赠者血中HBV DNA滴度和角膜上皮细胞中HBsAg表达的关联分析
捐赠者A1血中HBV DNA滴度相较于其他捐赠者具有量级上的差距,达到1.14×107 IU/ml(图2A)。通过ImageJ软件对切片做荧光半定量分析,上皮中检测到的HBsAg平均荧光强度在不同捐赠者和保存介质中的差异并无统计学差异。而在捐赠者A1的角膜上皮和内皮中HBsAg表达的差异具有统计学差异(P=0.0121,图2B)。由于仅有一例角膜样本检测出内皮有HBsAg表达,难以进行相关性分析比较,故将捐赠者血中HBV DNA滴度和角膜上皮细胞中HBsAg表达做一关联分析。捐赠者血中HBV DNA滴度数据量级相差较大,故将数据进行对数变换,使其符合正态分布后进行Pearson相关性分析,可见血中HBV DNA滴度和上皮细胞中HBsAg的表达呈正相关(R2=0.7073,P=0.0359,图2C)。所以我们推测,血中具有高HBV DNA滴度的捐赠者,越有可能在其角膜上皮细胞中高表达HBsAg。
讨 论
乙型肝炎病毒是一种由包膜和核壳体组成的嗜肝DNA病毒,可存在于血液和有血液流动的器官中[17]。由于正常角膜无血管,学界曾普遍认为角膜移植术不能传播乙型肝炎病毒[18]。但20世纪90年代,HoftRH等人报道了两例接受乙型肝炎表面抗原阳性供体角膜进行穿透性角膜移植术患者,术后发生乙型肝炎表面抗体阳性转化的病例[19]。随后Ahmad Khalil等人用ELISA法在HBsAg阳性患者捐献的供体角膜上皮和基质-内皮复合体中检测到了HBV DNA[20]。这提示因角膜移植造成的乙肝感染需要警惕。
随着角膜移植手术技术的进展,部分角膜移植可以通过成分移植实现,但针对HBsAg在角膜各层中定位的研究较为缺乏。本研究通过免疫荧光染色标记角膜石蜡切片中的HBsAg。结果表明,在部分HBsAg血清阳性供体角膜的角膜上皮和或内皮中可以检测到HBsAg,但角膜基质层中并未检测到HBsAg阳性信号,这为进一步研究HBsAg阳性供体角膜用于板层角膜移植的可能性奠定了基础。我们认为,通过去除供体角膜的上皮和内皮,制备用于角膜移植的板层角膜可能是使用HBsAg阳性角膜的一种方法。
聚维酮碘是一种广谱消毒剂,具有较低的细胞毒性,不易造成角膜上皮细胞的损伤,同时具有较强的消毒能力,可杀灭大部分细菌,常规用于供体角膜取材前的消毒。当在水中稀释时,聚维酮碘释放出游离碘,直接结合并破坏微生物的蛋白质结构,以及氧化蛋白结构中的双键,从而杀灭微生物[21]。本研究发现,聚维酮碘浸泡10分钟后的角膜组织中仍然可以检测到HBsAg,提示聚维酮碘浸泡10分钟不能灭活HBV,聚维酮碘消毒后的HBsAg阳性供体角膜仍然有HBV感染风险。
供体角膜保存方式主要有新鲜保存和非活性保存两种,本研究中A组4枚新鲜供体角膜在中期角膜保存液中存放小于14天,有两枚在上皮层和内皮层中均检测到HBsAg存在,基质层中未见。供体角膜的长期非活性保存可通过无水甘油实现,其可脱除角膜中的水分,抑制角膜细胞中的酶活性和自溶,但甘油保存的供体角膜上皮及内皮细胞均无活性,仅能用于板层角膜移植手术[22-23]。本研究B组及C组非活性保存的4枚供体角膜分别在甘油中浸泡1个月及1年,在保存一年的一枚供体角膜上皮中仍检测到了HBsAg,但在基质层中未检测到HBsAg信号,我们推测,可能由于角膜基质层纤维组织致密,细胞成分少,不利于HBV病毒的扩散,故在基质层中未检测到HBsAg信号。
HBV的DNA定量水平与病理变化之间存在相关性[24]。受制于实际捐赠情况,本研究检测了四位捐赠者血中的HBV DNA滴度,发现其与角膜上皮中HBsAg表达呈正相关,提示乙肝携带者或患者的血清病毒DNA载量有可能与角膜组织中病毒含量相关,血中HBV DNA滴度高表达的捐赠者,其角膜中可能更易发现HBsAg表达。但本研究标本数量有限,检测误差以及捐献者个体差异的存在都是此实验的局限性。根据本研究的结果,我们认为通过手术操作去除供体角膜中富含细胞且可携带病毒的上皮和内皮层,是可能降低角膜移植后HBV感染风险的潜在方法,HBsAg阳性捐献者的供体角膜可能用于板层角膜移植术,但还需要进一步的研究来验证其安全性。
结 论
HBsAg血清阳性捐献者的供体角膜无论是存放于中期角膜保存液或在甘油长期保存,均可在上皮和/或内皮中检测到HBsAg。血中HBV DNA滴度高表达的捐赠者,其角膜中可能更易发现HBsAg表达。为了缓解当前角膜供体的紧缺,角膜中HBV的灭活方法或使用HBsAg血清阳性供体角膜进行板层角膜移植的安全性值得进一步研究。
A vision for universal eye health
[J]. The Lancet, 2019, 394(10207): 1388. https://doi.org/10.1016/S0140-6736(19)32325-6.Accessible bioengineered corneal tissue to address a blinding disease globally
[J]. Nat. Biotechnol, 2023, 41(1): 25-26. https://doi.org/10.1038/s41587-022-01409-9.Usage of the Remained Tissues after Keratoplasty for Endothelial Keratoplasty
[J]. Ophthalmology, 2024. https://doi.org/10.1016/S0140-6736(12)60437-1.Corneal transplantation
[J]. The Lancet, 2012, 379(9827): 1749-1761. https://doi.org/10. 1016/j.ophtha.2023.12.024.Immune privilege in corneal transplantation
[J]. Prog Retin Eye Res, 2019, 72: 100758. https://doi.org/10.1016/j.preteyeres.2019.04.002.Corneal Donation: Current Guidelines and Future Direction
[J]. Clin Ophthalmol, 2021, 15: 2963-2973. https://doi.org/10.2147/OPTH. S284617.Chronic hepatitis B virus infection
[J]. The Lancet, 2018, 392(10161): 2313-2324. https://doi.org/10.1016/S0140-6736(18)31865-8.Detection of Hepatitis B Virus DNA in Pancreas, Kidney and Skin of Two Human Carriers of the Virus
[J]. J Gen Virol, 1984, 65(3): 651-655. https://doi.org/10.1099/0022-1317-65-3-651.Tears From Children With Chronic Hepatitis B Virus (HBV) Infection Are Infectious Vehicles of HBV Transmission: Experimental Transmission of HBV by Tears, Using Mice With Chimeric Human Livers
[J]. J Infect Dis, 2012, 206(4): 478-485. https://doi.org/10. 1093/infdis/jis293.The high expression of the pain-related inflammatory factors in the eyes of cataract patients infected with hepatitis B virus
[J]. Cytokine, 2020, 134: 155189. https://doi.org/10.1016/j.cyto.2020.155189.Artificial cornea: Myth or reality?
[J]. Acta Ophthalmol, 2022, 100(S275). https://doi.org/10.3389/fmed.2021. 770780.Artificial Cornea: Past, Current, and Future Directions
[J]. Front Med-prc, 2021, 8. https://doi.org/10.1111/j.1755-3768.2022.15489.Editorial on Maximize Donor Cornea Use in a Hepatitis B Endemic Area via Serology Matching
[J]. Transplantation, 2023, 107(6): 1242-1243. https://doi. org/10.1097/TP.0000000000004461.Corneal Transplantation From Donors With Hepatitis B: Preliminary Results
[J]. Am J Gastroenterol, 2019, 114(2): 362-364. https://doi.org/10. 14309/ajg.0000000000000052.国家卫生健康委办公厅关于印发眼库管理规范等文件的通知
[EB/OL].WHO 2030 HBV elimination goals: a goal too far?
[J]. Lancet Gastroenterol, 2023, 8(10): 862-863. https://doi.org/10. 1016/S2468-1253(23)00233-9.Hepatitis B transmission by cell and tissue allografts: How safe is safe enough?
[J]. World J Gastroentero, 2014, 20(23): 7434-7441. https://doi.org/10.3748/wjg.v20.i23.7434.Assessment of the infectivity of corneal buttons taken from hepatitis B surface antigen seropositive donors
.[J]. Br J Ophthalmol, 1995, 79(1): 6-9. https://doi.org/10.1136/bjo.79.1.6.Reduction of Ocular Surface Damage and Bacterial Survival Using 0.05% Povidone-Iodine Ocular Surface Irrigation before Cataract Surgery
[J]. Ophthalmic Res, 2019, 62(3): 166-172. https://doi.org/10. 1159/000501373.Extending the utility of anterior corneal buttons through refrigeration and glycerol cryopreservation: utility rate and outcome analysis
[J]. Br J Ophthalmol, 2022. https://doi.org/10.1136/bjo-2022-321433.Long-term preservation of donor corneas in glycerol for keratoplasty: exploring new protocols
[J]. Br J Ophthalmol, 2016, 100(2): 284-290. https://doi. org/10.1136/bjophthalmol-2015-306944.作者声称无任何利益冲突。
仁虹, 蔡子怡, 杜佳琪, 李高阳, 胡舒钰, 欧阳莎, 刘寒涵, 邓志宏. 中期保存液和甘油保存的血清HBsAg阳性供体角膜中HBsAg的表达[J]. 中南大学学报(医学版), 2024, 49(10): 1642-1648. DOI:10.11817/j.issn.1672-7347.2024.230564
REN Hong, CAI Ziyi, DU Jiaqi, LI Gaoyang, HU Shuyu, OUYANG Sha, LIU Hanhan, DENG Zhihong. Expression of HBsAg in corneas of serum HBsAg positive donors preserved with medium term preservation solution and glycerol[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1642-1648. DOI:10.11817/j.issn.1672-7347.2024.230564
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101642.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.230564

