上颌横向发育不足(maxillary transverse deficiency,MTD)是临床上常见的错牙合畸形[1]。对于青春前期腭中缝未闭合患者,上颌快速扩弓(rapid palatal expansion,RPE)是解决上颌宽度不足的主要治疗手段,但对青春后期和成人腭中缝已闭合患者,RPE和手术辅助RPE均存在一定弊端,如牙齿颊向倾斜,骨开窗,手术自身等风险[2-4]。微种植钉辅助上颌快速扩弓(miniscrew-assisted rapid palatal expansion,MARPE)不仅可以获得更多的骨效应,而且微种植钉植入简单、无需翻瓣、患者舒适、扩大了扩弓的年龄范围和适应证[5]。因此,MARPE方法的提出使非手术治疗青春后期和成年MTD患者成为可能,有广阔的应用前景[6-9]。
MARPE装置根据微种植钉植入先后顺序主要分为2大类。一类是先带扩弓器后植入微种植钉,以微种植钉辅助快速上颚扩展(micro-screw-assisted rapid palatal expansion,MSE)为代表]的共同就位道扩弓器[10-11]。这类扩弓器的种植钉植入技术敏感性高,患者硬腭生长情况限制MARPE装置的使用,且种植钉植入过深会损伤腭盖和鼻腔[12-14]。另一类是先植入微种植钉后带扩弓器(以基托式扩弓器为代表)的非共同就位道扩弓器[15-16]。这类扩弓器应用广泛,对微种植钉植入技术敏感性低,可根据患者治疗目的及局部骨质情况选择种植钉位置[16],但由于微种植钉和扩弓器之间通过聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)树脂进行固定连接,临床摘除困难,椅旁操作时间长,且在去除扩弓器过程中易损伤种植钉和黏膜,患者体验感不佳,极大的影响了临床进一步推广使用。
针对非共同就位道MARPE的摘除问题,目前缺乏关于从根本上解决固定材料和微种植钉之间相互嵌合导致临床去除扩弓器时材料和种植钉间分界不清的方法。因此,临床亟需设计制作一个力学性能优良且优化临床操作的活动连接装置。
受螺母螺帽和口腔种植牙封孔的启发,本研究通过3D打印技术中的立体光刻成型技术(stereolithography,SLA),经过特定的自动化过程逐层添加标准材料[17-21],制作与微种植钉外形合适的微种植钉帽。同时运用静电纺丝技术制作丝素蛋白(silk fibroin,SF)电纺膜,使微种植钉帽和微种植钉间形成紧密又独立的整体。其中,以往研究[22-28]已表明丝素蛋白具有无毒、无污染、无刺激、良好机械性能、卓越生物相容性等优点。本研究首先应用电镜(scanning electron microscopy,SEM)对SF电纺膜进行形貌观察,傅里叶红外光谱(Fourier-transform infrared spectroscope,FTIR)研究微种植钉帽和SF电纺膜的二级结构构象。运用拉伸和压缩实验研究微种植钉帽和SF电纺膜的力学性能。同时,在体外模拟应用,比较微种植钉帽与微种植钉帽和电纺膜2组在宏观和SEM镜下的密合性差异。此外,通过微种植钉帽和SF电纺膜与NIH3T3共同培养,探讨了二者的细胞相容性。最后,选择1例青春后期男性患者进行概念验证,验证非共同就位道MARPE活动连接装置的可行性,为解决非共同就位道MARPE固定连接问题提供新方法。
材料与方法
材料
三维(3 dimensional,3D)打印为中国普利生公司产品,3D创造程序(Cinema4D)为德国MAXON公司产品,VoxeldanceTango软件为中国漫格科技公司产品。JDF05静电纺丝机为中国纳仪仪器科技有限公司产品。扫描电子显微镜(scanning electron microscopy,SEM)为中国泰思肯有限公司产品。荧光显微镜为德国徕卡仪器有限公司产品。电子式万能试验机为中国岛津企业管理有限公司产品。微种植钉为德国登特伦公司产品。微孔板荧光仪为美国伯腾仪器有限公司产品。
牛血清白蛋白、青霉素和链霉素溶液和培养基均购自上海逍鹏生物科技有限公司。活/死检测试剂盒和CCK-8试剂盒均购自翌圣生物科技(上海)股份有限公司。
家蚕丝茧由西南大学基因组生物学国家重点实验室提供。成纤维细胞来源于美国型培养集合(NIH3T3细胞,小鼠胚胎成纤维细胞系)。
方法
设计制作微种植钉帽
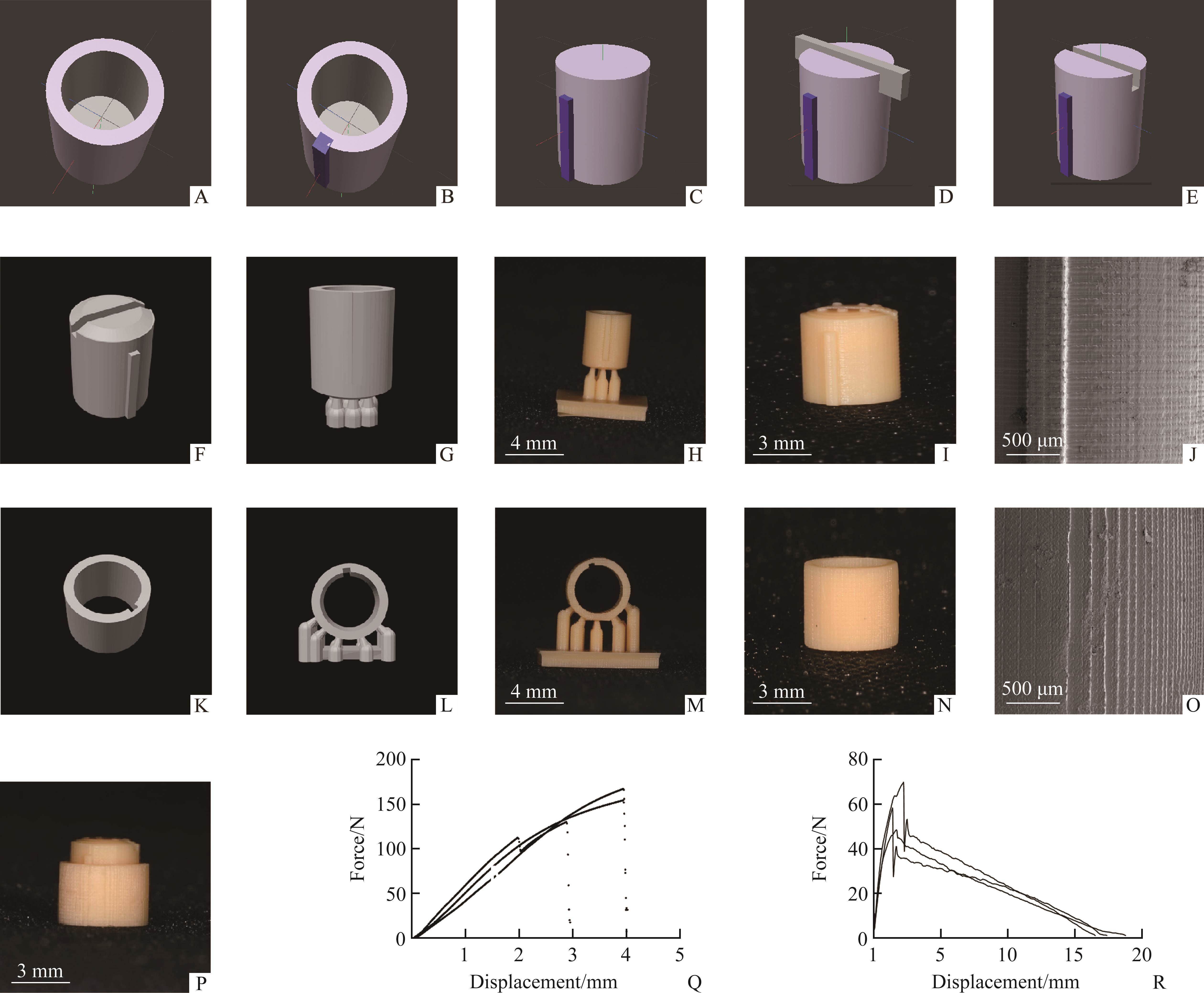
采用计算机辅助设计(computer aided design,CAD),应用3D打印SLA技术通过紫外激光束照射液态光敏树脂逐层固化,实现3D物体的构建制作。微种植钉帽由2部分组成,内部圆柱套筒和外部保护环。外部结构与树脂直接接触,通过破坏外部保护环以便于拔出内部圆柱套筒。
1)应用3D扫描系统记录种植钉数据,运用逆向工程软件Geomagic Wrap测量并生成最佳拟合数据(3D重建数据较直接测量数据更加精准且能模拟植入骨组织后状态)。
2)应用3D创造程序创建圆柱体(高=5 mm、直径=3.96 mm)与长方体1(长=4 mm、宽=0.55 mm、高=0.53 mm),随后将长方体放置在圆柱体周围(图1A~1C)。
3)创建2个不同直径的圆柱体并重叠其轴心与底部,根据种植体大小调整圆柱体内部直径,大圆柱体直径比小圆柱体直径至少大1 mm。将内部圆柱套筒壁固定为0.5 mm(壁过薄会造成强度不足,壁过厚会增加临床不适感及扩弓器制作难度)。圆柱体1与圆柱体2应用布尔运算减去重叠部分体积形成内部圆柱套筒(内部圆柱套筒紧密贴合种植体,使力能更好的传导至扩弓器)。
4)创建长方体(长=1.1 mm宽=0.5 mm高=6.0 mm),布尔运算减去内部圆柱套筒与长方体之间的重叠(凹槽设计允许临床使用一字螺丝刀辅助旋转)(图1D)。
5)布尔运算叠加圆柱套筒和长方体使其形成整体,生成完整内部圆柱套筒(图1E)(内部圆柱凸起结构与外部保护环凹槽结构契合,可防止转动)。
6)同理,圆柱体布尔运算减去长方体,生成外部保护环。导入VoxeldanceTango 2.11创建虚拟基台支架(图1G、1L)并存为STL文件。
静电纺丝制作SF电纺膜
SF/PEO水溶液的制备
SF水溶液的制备方法如文献所述[29-30],将蚕丝置于沸腾的0.02 M碳酸钠溶液中30 min脱胶,超纯水反复漂洗干净并干燥,处理后的蚕丝溶解在9.3 M溴化锂溶液中,在60 ℃下溶解4 h,超纯水中连续透析48 h,SF溶液离心去除不溶残留物稀释至7%(w/v)。将聚环氧乙烷(polyethylene oxide,PEO)(1 000 000 g/mol)溶在超纯水中制成4%(w/v)PEO水溶液。根据SF/PEO重量比分别为90/10,80/20,70/30制备不同浓度的SF/PEO水溶液,常温下磁力搅拌10 min,制得纺丝液,所有溶液均保存在4 ℃,待进一步使用。
SF/PEO水溶液的静电纺丝
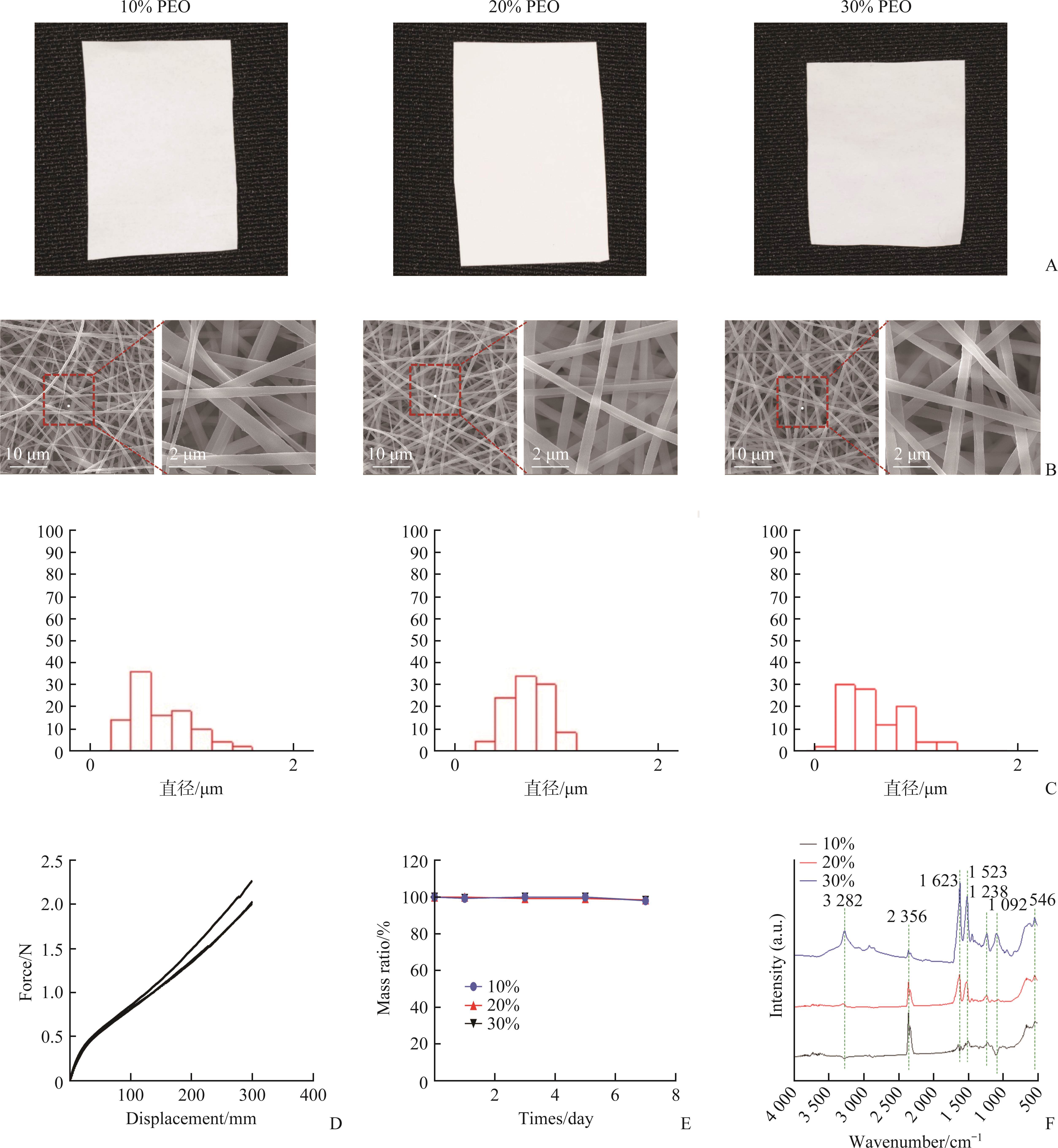
利用静电纺丝技术制备SF电纺膜。优化电纺参数以实现稳定可重复的纺丝,采用的纺丝参数为:纺丝电压14 kV;纺丝距离20 cm;助推泵流速设为1.5 mL/h;温度30 ℃;湿度30%相对湿度(relative humidity,RH)。将不同重量比的SF/PEO水溶液10 mL注入注射器中连续电纺,得到不同重量比的SF/PEO电纺膜,将所制的电纺膜置于60 ℃真空干燥箱24 h并将每张膜分成2份,1份备用,另1份水蒸气交联24 h,将膜进行分组。
SEM扫描电镜
采用扫描电子显微镜(scanning electron microscopy,SEM)获得电纺膜纤维的图像(图2B),为了提高样品的导电性,成像前在膜上进行喷金处理。从每种电纺膜图像中随机选择50根纤维来确定平均纤维直径(图2C)。
红外光谱
采用傅里叶红外光谱(Fourier-transform infrared spectroscope,FTIR)对不同浓度SF电纺膜进行测试,光谱范围500~4 000(图2F)。
微种植钉帽和SF电纺膜的机械性能及SF电纺膜的体外降解
通过电子式万能试验机进行压缩和拉伸实验,评估微种植钉帽和电纺膜的机械强度。
由于电纺膜用于口腔湿润环境下,为了准备湿态下的力学测试,在测试前将膜切割为3 cm×1 cm大小,浸入PBS中约5分钟,以确保达到充分水化,用上下夹板固定SF电纺膜,试验站传感器以10 mm/min的速度垂直向拉伸直至断裂(图2D)。同理,微种植钉帽内部圆柱套筒和外环固定在上下夹板内,试验站传感器以10 mm/min的速度垂直向拉伸直至分离(图1R)。最后将微种植钉帽横向放在刚性平台上,试验站传感器以10 mm/min的速度向下压至碎裂(图1Q),每个样品重复测量3次,均记录位移和力。将SF电纺膜制备成5 cm×2 cm大小置于离心管中,每支离心管加入10mL PBS缓冲液(pH=7.4),将离心管置于37 ℃恒温震荡水浴锅持续摇晃观察一周,分别在第1、3、7天取出浸泡样品,去离子水洗涤3次,置于干燥箱中充分干燥至恒重,称重,所有样品均称重3次取平均值(图2E)。计算质量比,质量比(%)=(W1÷W0)×100%。
微种植钉帽和SF电纺膜与微种植钉间的密合性
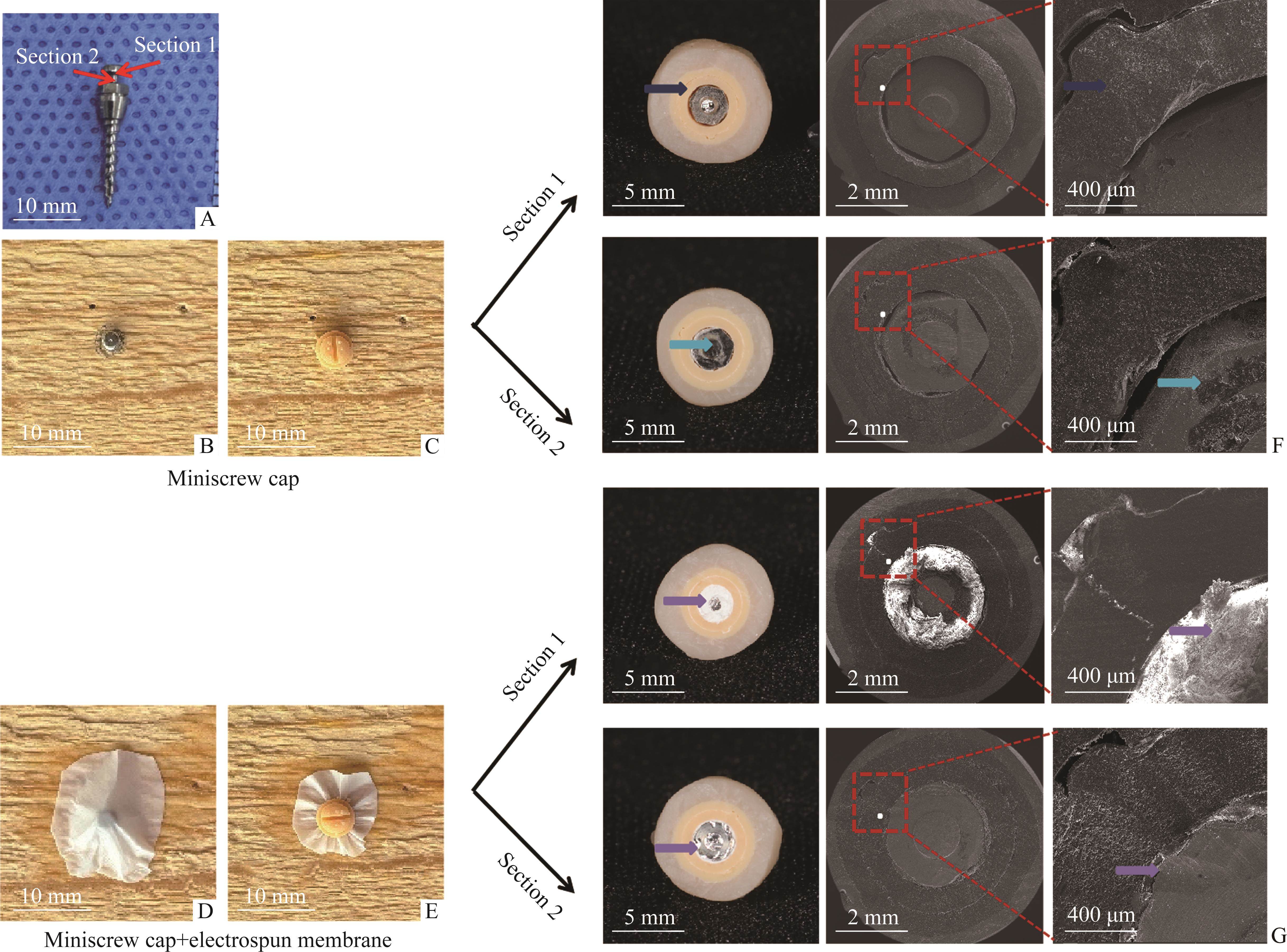
通过体外模拟应用,验证微种植帽与种植钉之间SF电纺膜的密合性。将2个种植钉帽分别盖在2颗1.4 mm×8 mm种植钉上,光固化树脂包埋,选取制备2个典型水平截面(图3A)。再用SF电纺膜包绕覆盖种植钉,盖种植钉帽,光固化树脂包埋,制备2个同水平对应截面。分别在宏观和SEM镜下对比微种植帽与种植钉之间SF电纺膜使用前后密合性差异(图3F、3G)。
SF电纺膜和微种植钉帽的生物细胞相容性
为评估微种植钉和SF电纺膜的生物相容性,本实验通过NIH3T3与对应2种成分(微种植钉帽和SF电纺膜)的提取液共培养评估其细胞存活率和活性。
细胞在含有10%牛血清白蛋白和1%青霉素和链霉素溶液的DEME培养基中,置于37 ℃和含5% CO2的细胞培养箱中培养。
根据ISO1993指南获取提取液,样品分别在DEME培养基中浸泡1 d。即SF电纺膜提取比为 0.1 g/mL(样品重量/提取介质体积),微种植钉帽提取比为3 cm2/mL(样品表面积/提取介质体积),提取液使用过滤器进行灭菌,NIH3T3细胞接种细胞密度为1.0×104 个/cm2的24孔板中,分别在DEME培养基、20%SF电纺膜提取液、微种植钉帽提取液及5%二甲基亚砜(dimethyl sulfoxide,DMSO)培养基中培养24 h。
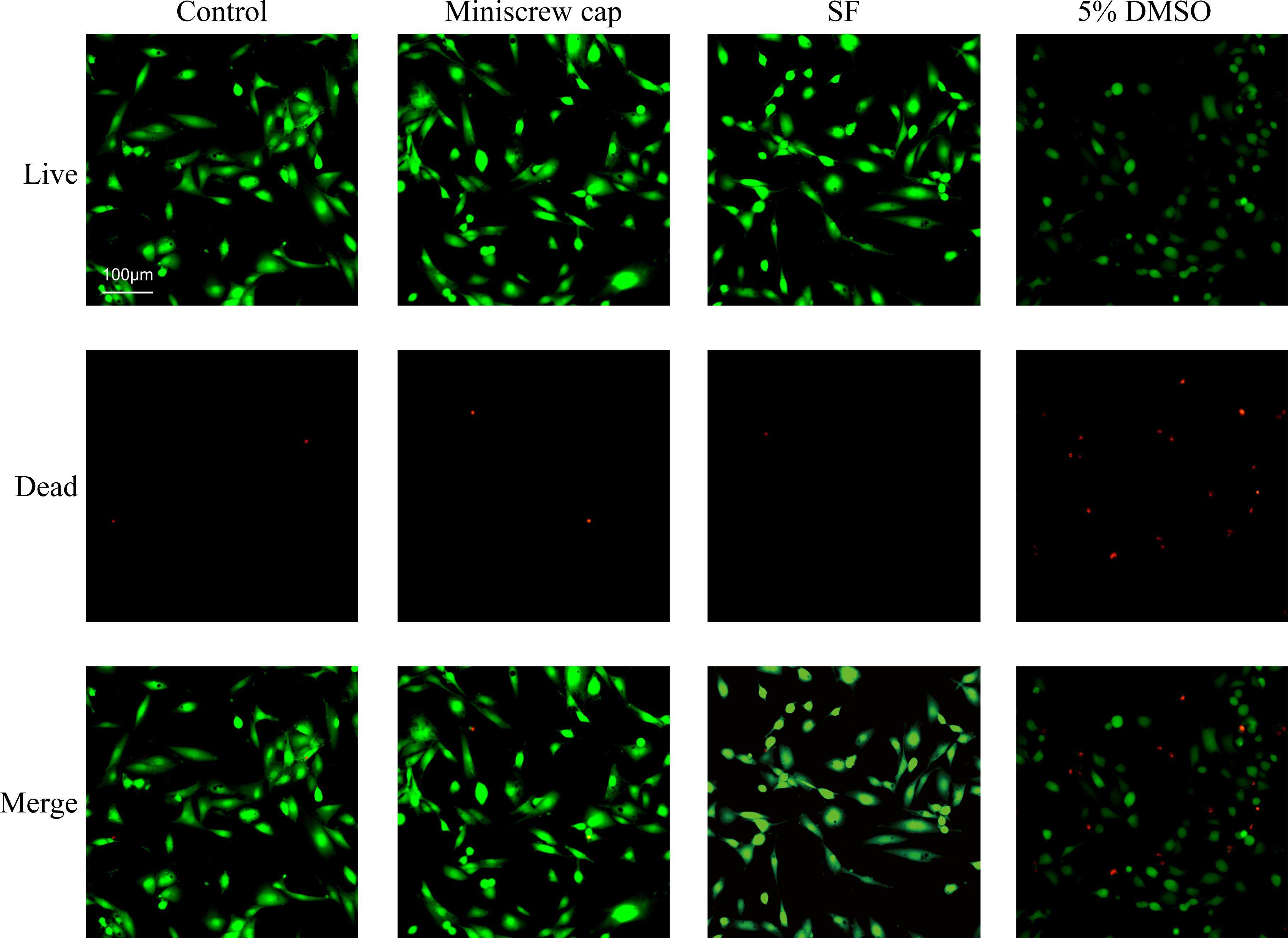
使用活/死检测试剂盒按照制造商说明进行细胞相容性评估。在荧光显微镜下观察细胞数目和形态(图5)。
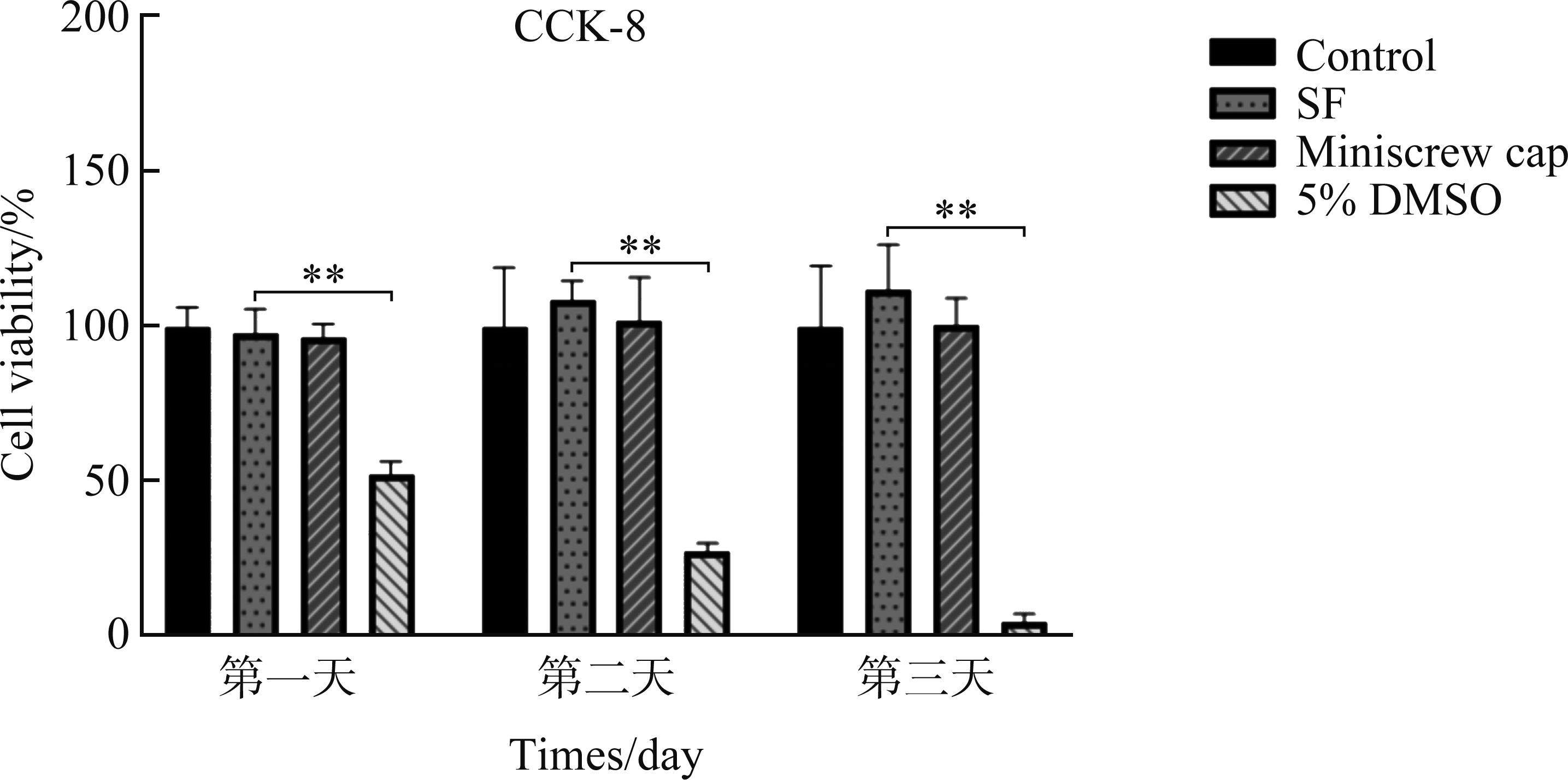
CCK8测定法在孵育第1、2和3 d后(n=4)用于定量评估细胞增殖。CCK8结果采用分光光度法监测按厂家说明书记录(图4)。
临床过程
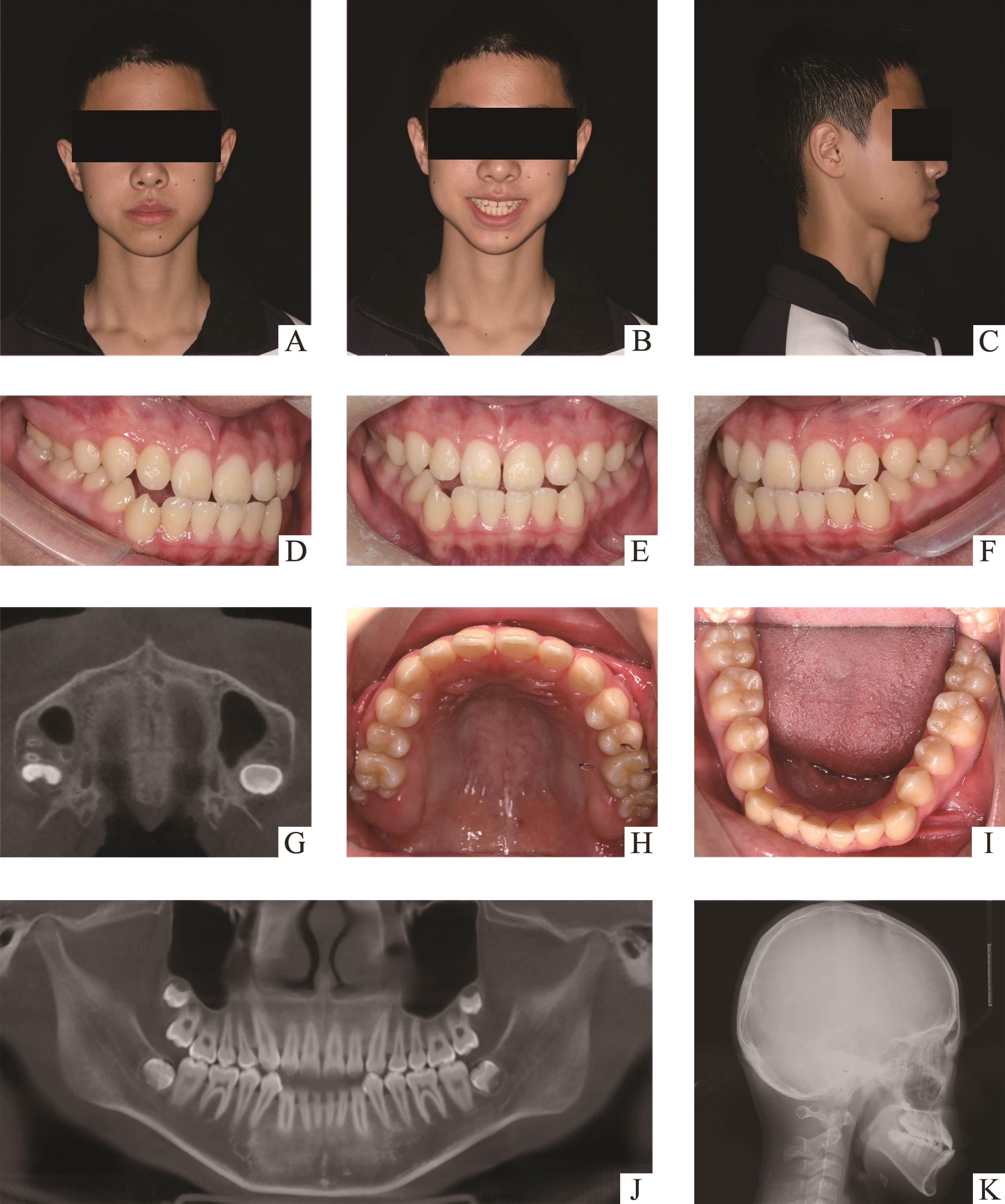
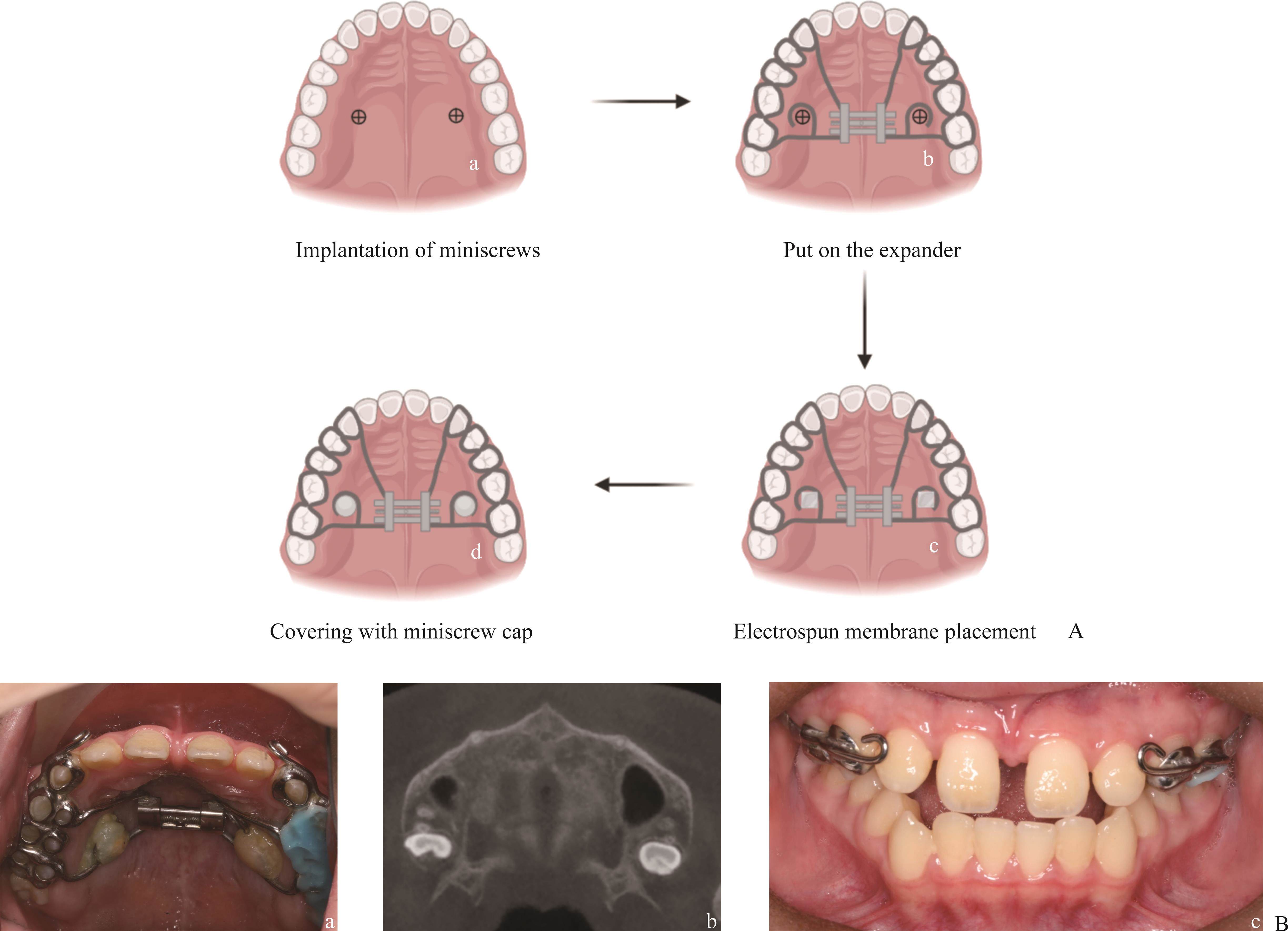
患者,男,13岁,因“地包天”于2023年11月14日到湖南中南大学湘雅口腔医院就诊。双侧颞下颌关节无弹响疼痛史。否认传染病史和药物过敏史。入院查体:面部不对称,颏部左偏,面下1/3稍长,侧面观为凸面型,下颌后缩。口内检查:恒牙列,双侧尖磨牙近中关系,上下中线不齐,下中线左偏 1 mm,反覆合反覆盖I度,上前牙散隙,33-43反合。模型分析:上颌拥挤度-1 mm,下颌拥挤度1 mm,Bolton指数为全牙比94.8%,下颌大3.4 mm,前牙比77.4%,下前牙大2 mm。头影测量示:SNA73.3°,SNB74.3°,ANB-1°,MP/SN50°,MP/FH38.2°。CBCT示:腭中缝分析D期。诊断为骨性III类、安氏III类、高角、下颌偏斜。治疗方案:双期矫治,I期扩弓+前牵,II期视I期治疗效果决定(图6A~6K)。所有操作均由同一名高年资正畸医生完成。首先,在CBCT上测量预植入点腭侧软硬组织厚度,选择微种植钉长度(1.4 mm×6 mm,1.4 mm×8 mm,1.4 mm×10 mm),于第二前磨牙和第一磨牙间骨质密度较佳处植入2颗微种植钉,iTero口腔内扫描,个性化制作牙骨混合支持式扩弓器。然后,试戴微种植钉帽和扩弓器,粘接固定扩弓器,润湿SF电纺膜,包绕覆盖微种植钉,戴微种植钉帽,光固化树脂连接扩弓器和微种植钉帽(图7A)。最后,嘱患者扩弓:1次/天,共28次,密切监测扩弓情况,当上颌中切牙间出现缝隙时,即认为扩张成功。MARPE结束后保持6个月,分离的腭中缝骨改建[31],6个月后去除扩弓器和种植钉,进行后续矫治。本研究获得了湖南中南大学湘雅口腔医院医学伦理委员会的批准(编号:20230017)。
统计学处理
采用GraphPad Prism 10统计学软件进行数据分析。数据均以均数±标准差表示,通过t检验(两组)或单因素方差分析(one-way ANOVA)评估不同数据之间的显著性差异,采用Tukey事后检验进行多重比较 (n=3)。P<0.05为差异具有统计学意义。
结 果
微种植钉帽的表征
Cinema4D微种植钉帽内部圆柱套筒和外部保护环的设计、支撑设计、实物打印以及最终套叠以待使用的流程可见图1A~1I、1K~1N和1P。在SEM镜下观察到3D分层打印形成的锯齿条纹状结构(图1J、1O)。微种植钉帽所能承受的最大应力和二者之间的最大摩擦力平均值为(148.61±15.29) N和(54.7±9.57) N(图1Q、1R)。
SF电纺膜的表征
不同质量比的SF/PEO电纺膜宏观图像无明显差异(图2A)。SEM镜下,10% PEO纤维直径差异大,30% PEO纤维直径较10% PEO纤维直径均匀,20% PEO电纺膜的纤维直径最为均匀(图2B、2C),且电纺过程最连续稳定,因此本实验选取20% PEO电纺膜。
湿态下测量膜的最大断裂应力为(2.46±0.26) N(图2D)。降解实验显示在第1、3、7天SF电纺膜重量无明显变化(图2E)。FTIR研究结果显示所有SF/PEO电纺膜都显示出相似的特征区。通过指纹区(800~1 800 cm-1)分析,鉴定出SF的3个特征波段为酰胺I(1 623 cm-1)、酰胺II(1 500~1 600 cm-1)和酰胺III(1 238 cm-1)。由于O-H和N-H基团的拉伸振动在3 200~3 600 cm-1之间出现宽强度带;2 885 cm-1附近的强波团源于对称和不对称的C-H拉伸;因为C-O基团不对称拉伸和C-O-H弯曲振动造成1 092 cm-1和546 cm-1处的波段(图2F)。
微种植钉帽和SF电纺膜与微种植钉间的密合性
登特伦微种植钉实物图和体外模拟使用所取截面1和截面2如图3A所示。微种植钉帽直接覆盖微种植钉(图3B~3C),微种植钉和帽子之间间隙明显(图3F)。电纺膜包绕覆盖微种植钉后戴微种植钉(图3D~3E)帽,微种植钉和帽子之间密实无明显间隙(图3G)。
微种植钉帽和SF电纺膜的生物相容性
CCK8实验结果显示:孵育第3天后,微种植钉组和SF电纺膜组存活率均较高,分别为100.36%和111.46%,此外SF电纺膜组细胞活性有增高的趋势(图4)。NIH3T3经Calcein-AM和PI染色在荧光显微镜下观察,空白对照组、SF电纺膜组和微种植钉帽组均呈现典型的成纤维细胞样形态且存活率高,而DMSO阴性对照组细胞明显形态欠佳且存活率低(图5)。这说明微种植钉帽和SF电纺膜具体良好的细胞生物相容性。
概念验证
患者经过非共同就位道MARPE扩弓1次/天,共28次后,11.21间缝隙明显增大,宽度为2.5 mm,腭中缝成功打开,上下前牙由反合到对刃,前牙反合改善(图7Bc),6个月后复查CBCT,腭中缝虽有部分骨改建,但仍可以看到明显打开的腭中缝(图7Bb)。
讨 论
3D打印医用材料包括金属、有机高分子和无机非金属材料3大类。本实验选用有机高分子专用树脂材料具有耐腐蚀、机械性能好,易于破除且价格合理便于一次性使用等优势。首先,微种植钉帽在保证机械强度的情况下尽可能将体积缩至最小,且内部圆柱凸起设计和外环凹槽契合可以有效的防止受力过程中发生旋转。其次,微种植钉帽内外二者间的平均摩擦力达到(54.7±9.57) N,这可能与SEM镜下分层锯齿状结构以及树脂打印后本身微弹性有关。最后,正畸矫形负载通常为水平向连续力,矫形过程中负载约为(0.98-14.7) N[32],而微种植钉帽所能承受的平均力为(148.61±15.29) N,其所能承受的压力远远大于正畸矫形力,因此,本实验设计制作的活动连接装置足以为临床所用。
相比于其他医用高分子材料,丝素蛋白具有独特的优势,它作为天然高分子材料,有良好的可再生性、生物相容性、以及较低的免疫性,并于1993年,美国食品和药物管理局(FDA)定义丝素蛋白为安全的生物材料,广泛应用于医学领域[33]。本实验SF电纺膜是由丝素蛋白和聚氧化乙烯(PEO)通过静电纺丝技术制成。其一,在湿润状态下力学性能优良断裂应力平均为(2.46±0.26) N,比之前文献研究结果稍高[23, 34],这可能与电纺膜的厚度,溶剂的质量分数以及交联方式等有关。其二,在与NIH3T3共培养的过程中,细胞活性高且活性有增高的趋势,其原因可能与SF的再生作用有关,这与早期研究一致[35-38],展示了电纺膜卓越的生物相容性。其三,MARPE扩弓过程中,微种植钉周围黏膜炎症发病率高[39],实验选用SF电纺膜作为微种植钉覆盖膜,高表面积有利于携带各种功能的添加剂,如抗菌剂、生长因子等,可以更好的预防感染,促进组织的恢复[40-42],有广阔切实可行的研究前景。
非共同就位道MARPE活动连接装置包括微种植钉帽和SF电纺膜。首先,与传统MARPE装置固定连接相比,结合了铸造式扩弓器的舒适和基托式扩弓器的连接密实等优点,而且连接装置使扩弓器拥有了预制式扩弓器活动连接的优势,在拆除过程中,微种植钉帽易于破除,极大缩短了摘除扩弓器的椅旁操作时间。其次,微种植钉帽和电纺膜结合密实能很好的维护微种植钉周围卫生,防止食物残渣附着,减小微种植钉周围炎症发生的可能性,从而降低微种植钉的脱落率。最后,由于种植钉和扩弓器之间距离较大,因此扩弓器在摘戴过程中无需考虑就位道,且在必要情况下可中途去除扩弓器进行二次扩弓,为临床提供了极大的便利,减轻了患者的痛苦。
本实验患者男性,13岁,青春后期,根据Angelieri等[43]腭中缝分期为D期,采用非共同就位道MARPE扩弓28天后,中切牙出现2.5 mm间隙,扩弓6个月后CBCT显示腭中缝明显增宽,表明腭中缝成功打开,证明了非共同就位道MARPE的活动连接装置设计达到预期治疗效果。但是,与传统固定连接相比,本研究所利用的非共同就位道MARPE的活动连接装置是能否承受同等的矫形力,将青春后期和成人患者腭中缝打开有待进一步临床研究验证。
综上所述,非共同就位道MARPE的活动连接装置力学性能及生物相容性良好,能有效地打开D期腭中缝,操作简便并有良好临床应用前景。
Miniscrew-assisted nonsurgical palatal expansion before orthognathic surgery for a patient with severe mandibular prognathism
[J]. Am J Orthod Dentofacial Orthop, 2010, 137(6): 830-839. https://doi.org/10. 1016/j.ajodo.2007.10.065.Surgical and non-surgical maxillary expansion: expansion patterns, complications and failures
[J]. Orthod Fr, 2022, 93(The difference of stress distribution of maxillary expansion using rapid maxillary expander (RME) and maxillary skeletal expander (MSE)-a finite element analysis
[J]. Prog Orthod, 2018, 19(1): 33. https://doi. org/10.1186/s40510-018-0229-x.Maxillary expansion and its effects on circummaxillary structures: a review
[J/OL]. Cureus, 2023, 15(1): e33755[Efficacy of Miniscrew-Assisted Rapid Palatal Expansion (MARPE) in late adolescents and adults with the Dutch Maxillary Expansion Device: a prospective clinical cohort study
[J]. Clin Oral Investig, 2022, 26(10): 6253-6263. https://doi.org/10.1007/s00784-022-04577-9.Microimplant-assisted rapid palatal expansion appliance to orthopedically correct transverse maxillary deficiency in an adult
[J]. Am J Orthod Dentofacial Orthop, 2016, 149(5): 716-728. https://doi.org/10. 1016/j.ajodo.2015.04.043.Extensiometric analysis of strain in craniofacial bones during implant-supported palatal expansion
[J]. J Mech Behav Biomed Mater, 2017, 76: 104-109. https://doi.org/10.1016/j.jmbbm.2017. 05.028.Nonsurgical miniscrew-assisted rapid maxillary expansion results in acceptable stability in young adults
[J]. Angle Orthod, 2016, 86(5): 713-720. https://doi.org/10.2319/101415-689.1.Effects of miniscrew location on biomechanical performances of bone-borne rapid palatal expander to midpalatal suture: a finite element study
[J]. Med Eng Phys, 2022, 107: 103872. https://doi. org/10.1016/j.medengphy.2022.103872.Changes in the midpalatal and pterygopalatine sutures induced by micro-implant-supported skeletal expander, analyzed with a novel 3D method based on CBCT imaging
[J]. Prog Orthod, 2017, 18(1): 34. https://doi.org/10.1186/s40510-017-0188-7.Midfacial changes in the coronal plane induced by microimplant-supported skeletal expander, studied with cone-beam computed tomography images
[J]. Am J Orthod Dentofacial Orthop, 2018, 154(3): 337-345. https://doi.org/10. 1016/j.ajodo.2017.11.033.Non-surgical treatment of transverse deficiency in adults using Microimplant-assisted Rapid Palatal Expansion (MARPE)
[J]. Dental Press J Orthod, 2017, 22(1): 110-125. https://doi.org/10. 1590/2177-6709.22.1.110-125.sar.Efficacy of Miniscrew-Assisted Rapid Palatal Expansion (MARPE) in late adolescents and adults: a systematic review and meta-analysis
[J]. Eur J Orthod, 2021, 43(3): 313-323. https://doi.org/10.1093/ejo/cjab005.Mini-implant selection protocol applied to MARPE
[J]. Dental Press J Orthod, 2018, 23(5): 93-101. https://doi.org/10.1590/2177-6709.23.5.093-101.sar.Tooth-borne vs bone-borne rapid maxillary expanders in late adolescence
[J]. Angle Orthod, 2015, 85(2): 253-262. https://doi.org/10.2319/030514-156.1.Miniscrews position for a tissue bone borne palatal C-expander affects the displacement pattern of nasomaxillary complex: a finite element study
[J]. Sci Rep, 2023, 13(1): 17135. https://doi.org/10.1038/s41598-023-44432-9.A review of 3D printing in dentistry: technologies, affecting factors, and applications
[J]. Scanning, 2021, 2021: 9950131. https://doi.org/10.1155/2021/9950131.3D打印仿生支架在脊髓损伤修复中的研究进展
[J]. 实用医学杂志, 2022, 38(22): 2868-73. https://doi. org/10.3969/j.issn.1006-5725.2022.22.019ZHANG Hao,Trueness and surface characteristics of 3-dimensional printed casts made with different technologies
[J]. J Prosthet Dent, 2024, 132(6): 1324.e1-1324.e11. https://doi.org/10.1016/j.prosdent.2022.12.002.Stereolithography 3D printing of microcapsule catalyst-based self-healing composites
[J]. ACS Appl Polym Mater, 2020, 2(11): 5048-5057. https://doi.org/10.1021/acsapm.0c00872.Silk as a biomaterial
[J]. Prog Polym Sci, 2007, 32(8/9): 991-1007. https://doi.org/10.1016/j.progpolymsci. 2007.05.013.Ultrasound sonication prior to electrospinning tailors silk fibroin/PEO membranes for periodontal regeneration
[J]. Mater Sci Eng C Mater Biol Appl, 2019, 98: 969-981. https://doi.org/10.1016/j.msec.2019.01.055.Biocompatible scaffold based on silk fibroin for tissue engineering applications
[J]. J Inst Eng Ind Ser C, 2023, 104(1): 201-217. https://doi.org/10.1007/s40032- 022-00891-z.Functional silk fibroin hydrogels: preparation, properties and applications
[J]. J Mater Chem B, 2021, 9(5): 1238-1258. https://doi.org/10.1039/d0tb02099k.Geometrical effects on the magnetic properties of nanoparticles
[J]. Nano Lett, 2016, 16(4): 2885-2889. https://doi.org/10.1021/acs.nanolett.6b00916.Engineered Films of Bombyx mori Silk with Poly(ethylene oxide)
[J]. MRS Online Proc Libr, 2003, 735(1): 1111. https://doi.org/10.1557/PROC-735-C11.11.Ag/silk fibroin nanofibers: Effect of fibroin morphology on Ag+ release and antibacterial activity
[J]. Eur Polym J, 2015, 67: 99-112. https://doi. org/10.1016/j.eurpolymj.2015.03.068.Micro-arc oxidation-assisted Sol-gel preparation of calcium metaphosphate coatings on magnesium alloys for bone repair
[J]. Mater Sci Eng C Mater Biol Appl, 2021, 131: 112491. https://doi.org/10.1016/j.msec. 2021.112491.Macro/microporous silk fibroin scaffolds with potential for articular cartilage and Meniscus tissue engineering applications
[J]. Acta Biomater, 2012, 8(1): 289-301. https://doi.org/10.1016/j.actbio.2011.09.037.Density of the midpalatal suture after RME treatment-a retrospective comparative low-dose CT-study
[J]. Head Face Med, 2014, 10: 18. https://doi.org/10.1186/1746-160X-10-18.应用种植支抗进行颌面部矫形的研究进展
[J]. 国际口腔医学杂志, 2009, 36(3): 364-366. https://doi.org/10.3969/j.issn.1673-5749.2009.03.035.Silk fibroin as biomaterial for bone tissue engineering
[J]. Acta Biomater, 2016, 31: 1-16. https://doi.org/10.1016/j.actbio.2015.09.005.Treatment of silk fibroin with poly(ethylene glycol) for the enhancement of corneal epithelial cell growth
[J]. J Funct Biomater, 2015, 6(2): 345-366. https://doi.org/10.3390/jfb6020345.Electrodeposited assembly of additive-free silk fibroin coating from pre-assembled nanospheres for drug delivery
[J]. ACS Appl Mater Interfaces, 2020, 12(10): 12018-12029. https://doi.org/10.1021/acsami. 9b21808.Electrophoretic deposition of coatings for local delivery of therapeutic agents
[J]. Prog Mater Sci, 2023, 136: 101111. https://doi.org/10.1016/j.pmatsci.2023. 101111.Drug-loaded mucoadhesive microneedle patch for the treatment of oral submucous fibrosis
[J]. Front Bioeng Biotechnol, 2023, 11: 1251583. https://doi.org/10.3389/fbioe.2023.1251583.The molecular conformation of silk fibroin regulates osteogenic cell behavior by modulating the stability of the adsorbed protein-material interface
[J]. Bone Res, 2021, 9(1): 13. https://doi.org/10.1038/s41413-020-00130-0.不同牙周表型对微种植支抗钉稳定性的影响
[J]. 口腔医学研究, 2023, 39(2): 124-128. https://doi.org/10.13701/j.cnki.kqyxyj.2023.02.007.Advances in wound dressing based on electrospinning nanofibers
[J/OL]. J Appl Polym Sci, 2024, 141(1): e54746[Silk fibroin: an emerging biocompatible material for application of enzymes and whole cells in bioelectronics and bioanalytical sciences
[J]. ACS Biomater Sci Eng, 2020, 6(8): 4337-4355. https://doi.org/10. 1021/acsbiomaterials.9b01971.Ag@AgCl nanoparticles in situ deposited cellulose acetate/silk fibroin composite film for photocatalytic and antibacterial applications
[J]. Cellulose, 2020, 27(13): 7721-7737. https://doi.org/10.1007/s10570-020-03321-4.Midpalatal suture maturation: classification method for individual assessment before rapid maxillary expansion
[J]. Am J Orthod Dentofacial Orthop, 2013, 144(5): 759-769. https://doi.org/10.1016/j.ajodo. 2013.04.022.作者声称无任何利益冲突。
伍水平, 许钰涵, 李英杰, 朱伟, 张振龙, 张灵玲, 李成日, 陈君捷, 钱柳, 李宇思, 程岘, 刘焱萍, 卢燕勤. 新型活动连接装置用于非共同就位道MARPE[J]. 中南大学学报(医学版), 2024, 49(10): 1649-1662. DOI:10.11817/j.issn.1672-7347.2024. 240283
WU Shuiping, XU Yuhan, LI Yingjie, ZHU Wei, ZHANG Zhenlong, ZHANG Lingling, LI Chengri, CHEN Junjie, QIAN Liu, LI Yusi, CHENG Xian, LIU Yanping, LU Yanqin. A new removable connecting device for MARPE expander with non-common path insertion[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1649-1662. DOI:10.11817/j.issn.1672-7347.2024.240283
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101649.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.240283

