脊柱肿瘤及脊柱感染均为脊柱常见疾病,二者早期临床症状多表现为腰背部疼痛,影像学检查均可见椎体骨质破坏、塌陷、病理学骨折等表现,临床鉴别诊断难度较大[1]。脊柱肿瘤多为恶性病变,手术切除是最佳的治疗方式;脊柱感染为良性病变,临床多采用规范的抗感染治疗方案,手术仅作为辅助治疗手段。早期准确鉴别诊断脊柱肿瘤与脊柱感染有助于明确治疗方案,预防神经功能障碍和脊柱畸形的发生,改善患者预后。目前临床鉴别诊断脊柱感染与脊柱肿瘤需要取组织标本行病理学检查,但穿刺活检或手术切除病灶均为有创操作,有损伤重要组织、血管和导致肿瘤转移、感染播散等风险。肿瘤标志物是存在于肿瘤细胞内、由肿瘤细胞产生或宿主受肿瘤刺激而产生的物质,包括肿瘤细胞的代谢产物、肿瘤细胞坏死分解后释放入血液循环的物质、宿主细胞对肿瘤的反应性产物等,能够反映肿瘤的发生发展和监测肿瘤对治疗的反应[2-3]。研究[4-5]显示,血常规、C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、降钙素原(procalcitonin,PCT)等常规实验室指标常用于感染性疾病的诊断,但这些指标在非感染性疾病中的诊断特异性较差。目前,血清学肿瘤标志物可作为门诊影像学疑似脊柱肿瘤患者的重要筛查指标,但脊柱肿瘤不同于其他部位的原发肿瘤,并无特异性肿瘤标志物[2]。本研究回顾性收集了门诊影像学提示脊柱肿瘤或脊柱感染患者入院时一般资料和血清肿瘤标志物数据,通过分析各项血清肿瘤标志物的表达水平来筛选与脊柱肿瘤早期鉴别诊断相关的肿瘤标志物,并构建早期鉴别诊断模型,评估其诊断效能。
资料与方法
一般资料
本研究纳入了中南大学湘雅医院2017年4月至2022年10月收治的221例疑似脊柱肿瘤或脊柱感染的骨质破坏患者。本研究获得中南大学湘雅医院伦理委员会批准实施(审批号:201303232),入组受试者及其家属知晓本研究的大致内容和目的,并签署了知情同意书。
诊断标准、纳入标准和排除标准
脊柱肿瘤诊断标准:患者经穿刺活检或开放手术获取的病灶组织行病理学检验提示肿瘤性病变。脊柱感染诊断标准:1)穿刺活检或开放手术获取的病灶组织的病理学检验提示存在感染(包括炎性病变、化脓性炎、肉芽肿性炎等);2)病灶组织的细菌或真菌培养结果或涂片结果呈阳性;3)病灶组织结核分枝杆菌群DNA检测(Xpert Mycobacterium tuberculosis/rifampicin,Xpert MTB/RIF)呈阳性。符合上述3项中的任意一项即可确诊脊柱感染。
纳入标准:1)病历资料(包括入院时一般资料、血清肿瘤标志物检验结果)完整的患者;2)门诊实验室检查结果和影像学资料显示疑似脊柱肿瘤或脊柱感染的患者;3)入院后行手术治疗(穿刺活检或开放手术)且有明确的病理诊断结果的患者[6]。排除标准:1)入组前1个月内有重大外伤史、手术史的患者;2)合并自身免疫性疾病、慢性消耗性疾病的患者;3)合并严重的心、肺、肾等脏器功能疾病以及多器官功能衰竭的患者;4)既往有恶性肿瘤史或肿瘤合并感染的患者[7]。
肿瘤标志物检测方法
采集所有受试者入院后第2天清晨空腹外周静脉血5 mL,3 500 r/min离心10 min,留取上清液保存于4 ℃冰箱中待检。采用化学发光法测定肿瘤标志物水平,多肿瘤标志物定量检测试剂盒购自上海透景生命科技有限公司,操作步骤严格按照说明书执行。各项肿瘤标志物的正常参考值为:癌胚抗原(carcinoembryonic antigen,CEA)<5 ng/mL,甲胎蛋白(alpha fetoprotein,AFP)<20 ng/mL,神经元特异性烯醇化酶(neuron-specific enolase,NSE)<13 ng/mL,细胞角蛋白19片段抗原21-1(cytokeratin 19 fragment antigen 21-1,cyfra21-1)<3.3 ng/mL,糖类抗原199(glycan antigen 199,CA199)<35 U/mL,糖类抗原125(carbohydrate antigen 125,CA125)<35 U/mL,糖类抗原72-4(carbohydrate antigen 72-4,CA72-4)<6.9 U/mL,胃蛋白酶原I(pepsinogen I,PGI) 30~300 ng/mL,胃蛋白酶原II(pepsinogen II,PGII)<15 ng/mL,胃蛋白酶原I与胃蛋白酶原II比值(pepsinogen I to pepsinogen II ratio,PGR)>3。
统计学处理
采用SPSS 20.0软件和GraphPad Prism 9对样本数据进行统计学分析。计量资料不符合正态分布,采用中位数(第1四分位数,第3四分位数)进行描述,组间比较采用非参数检验;计数资料以例数和百分比(%)表示,组间比较采用χ2检验。采用logistics分析筛选危险因素,采用斯皮尔曼(Spearman)相关系数进行相关性分析,检验结果以P表示,当P<0.05时认为具有相关性(P<0.05为弱相关,P<0.01为中等相关,P<0.001为强相关),结果以相关性热图呈现。诊断结果在http://vassarstats.net/clin1.html#return网站上进行计算[8]。所有图形的绘制使用R语言4.3.0版本,受试者操作特征(receiver operator characteristic,ROC)曲线的计算使用pROC包,ROC曲线和曲线下面积(area under the curve,AUC)柱状图的绘制使用tidyverse包完成;相关性热图的绘制使用corplot包完成;森林图的绘制使用forestplot包完成。绘制出ROC曲线后,计算出约登指数(敏感度+特异度-1)最大时对应的切点为诊断脊柱肿瘤的最佳临界值(cut-off值)。
结 果
基本情况
根据本研究的纳入标准,共纳入了221例脊柱骨质破坏患者,依照病理学诊断结果,其中91例患者确诊为脊柱肿瘤,其他130例患者确诊为脊柱感染。脊柱肿瘤组与脊柱感染组患者的年龄和性别比较,差异无统计学意义(P>0.05);在血清肿瘤标志物比较方面,除CA125、PGI、PGII外,脊柱肿瘤组CEA、AFP、NSE、cyfra21-1、CA199、CA72-4水平均高于脊柱感染组,PGR低于脊柱感染组,差异均有统计学意义(均P<0.05,表1)。
| 变量 | 脊柱感染组(n=130) | 脊柱肿瘤组(n=91) | Z | P |
|---|---|---|---|---|
| 性别/[例(%)] | 0.677 | 0.493 | ||
| 女 | 63(48.46) | 39(42.86) | ||
| 男 | 67(51.54) | 52(57.14) | ||
| 年龄/岁 | 55.0(49.0, 62.0) | 55.0(48.0, 66.0) | -0.83 | 0.357 |
| CEA/(ng·mL-1) | 0.74(0.37, 1.12) | 1.09(0.60, 2.08) | -3.957 | <0.001 |
| AFP/(ng·mL-1) | 1.39(1.02, 2.08) | 1.93(1.46, 2.91) | -4.945 | <0.001 |
| NSE/(ng·mL-1) | 4.56(3.21, 6.18) | 5.58(3.74, 7.58) | -2.584 | <0.05 |
| cyfra21-1/(ng·mL-1) | 0.92(0.66, 1.25) | 1.64(0.85, 2.98) | -5.541 | <0.001 |
| CA199/(U·mL-1) | 5.66(3.90, 10.38) | 10.34(5.76, 19.44) | -4.25 | <0.001 |
各项血清肿瘤标志物的相关性分析
通过单因素logistic分析绘制出ROC曲线(图1A),并将结果用柱状图展示(图1B)。对10种肿瘤标志物进行相关性分析,并绘制出相关性热图,结果显示CEA与cyfra21-1、CA199、CA125存在强正相关性,PGII与PGI、PGR存在强负相关性(图1C)。
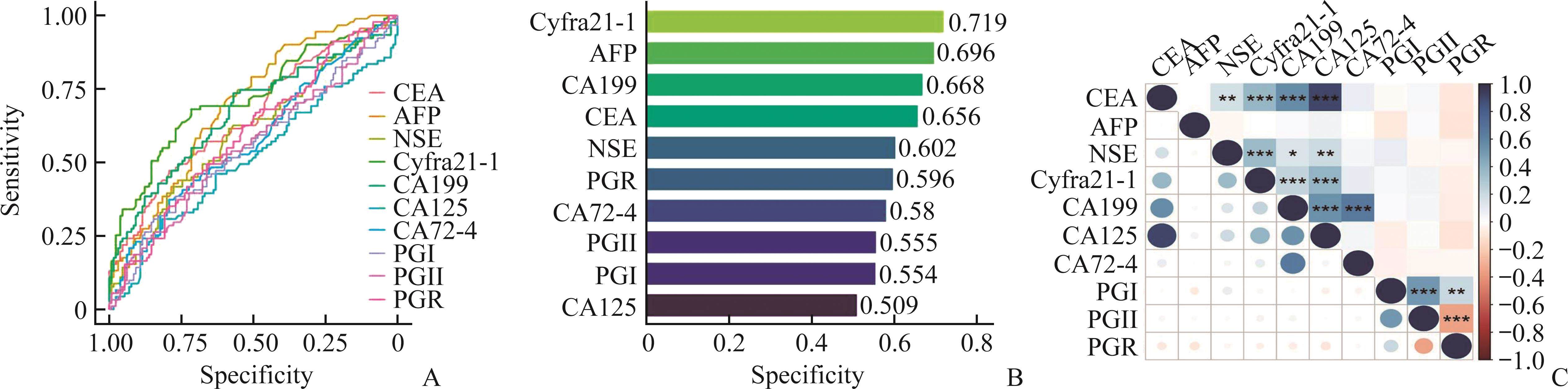
血清肿瘤标志物在脊柱肿瘤和脊柱感染早期鉴别诊断中的单因素和多因素logistics分析
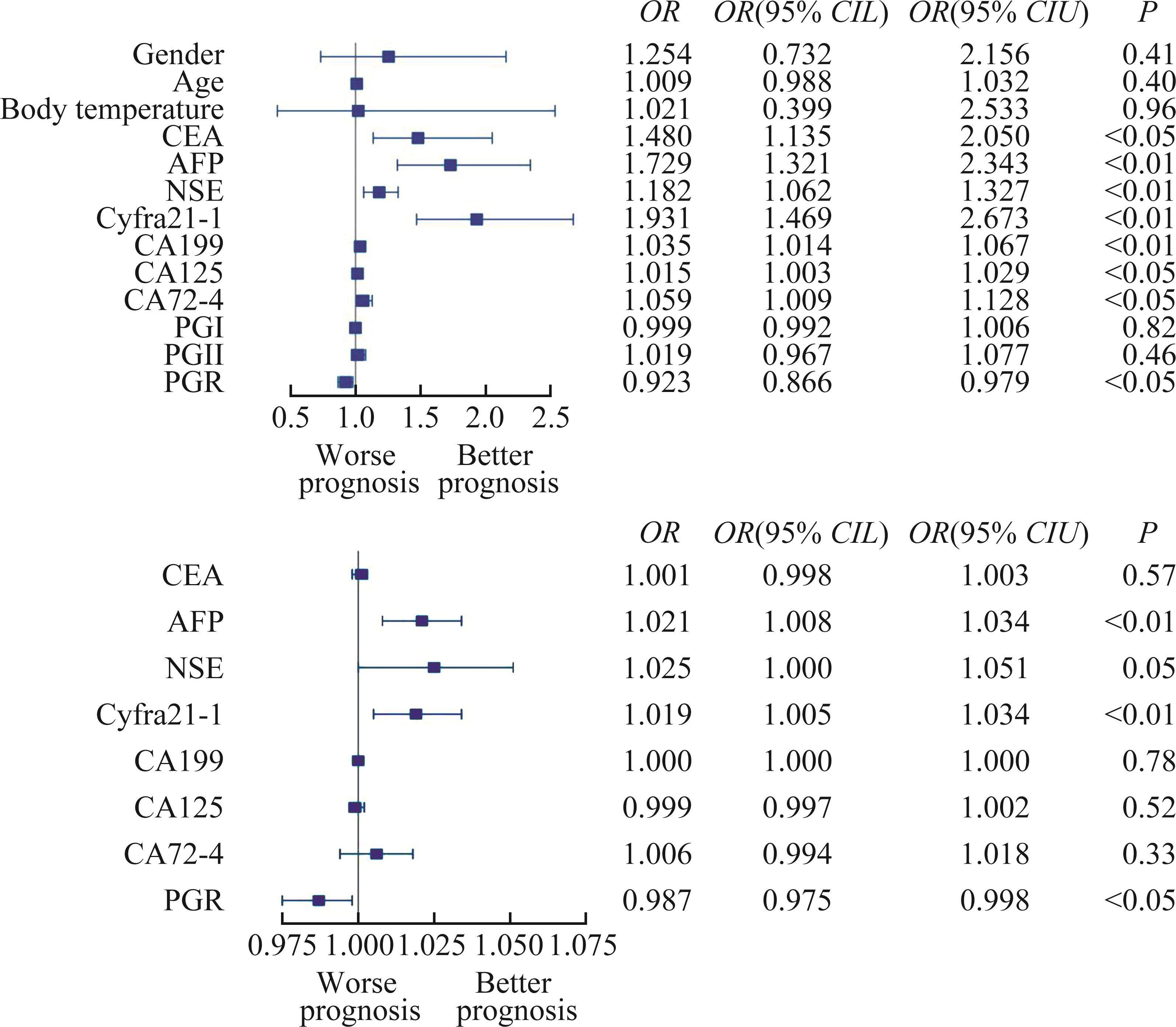
肿瘤标志物在脊柱肿瘤与脊柱感染早起鉴别诊断中的单因素和多因素logistics回归分析结果见表2,单因素logistic回归分析显示,CEA、AFP、NSE、cyfra21-1、CA199、CA125、CA724、PGR的差异有统计学意义(P<0.05);将上述8个指标纳入多因素logistic回归分析后,绘制出森林图(图2),发现AFP和cyfra21-1是脊柱肿瘤早期诊断的危险因素(P<0.01),PGR为保护因素(P<0.05)。
| 变量 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| OR | 95%置信区间 | P | OR | 95%置信区间 | P | |
| 性别 | 1.253 7 | 0.732 1~2.156 3 | 0.41 | — | — | — |
| 年龄 | 1.009 3 | 0.989 0~1.031 6 | 0.4 | — | — | — |
| 体温 | 1.021 3 | 0.399 1~2.533 4 | 0.96 | — | — | — |
| CEA | 1.480 2 | 1.135 4~2.050 4 | <0.05 | 1.001 | 0.998~1.003 | 0.57 |
| AFP | 1.728 9 | 1.320 7~2.343 3 | <0.01 | 1.021 | 1.008~1.034 | <0.01 |
| NSE | 1.182 4 | 1.062 2~1.326 9 | <0.01 | 1.025 | 1.000~1.051 | 0.05 |
| cyfra21-1 | 1.931 3 | 1.468 7~2.672 6 | <0.01 | 1.019 | 1.005~1.034 | <0.01 |
| CA199 | 1.035 4 | 1.013 8~1.066 8 | <0.01 | 1.000 | 1.000 | 0.78 |
| CA125 | 1.014 5 | 1.002 5~1.029 0 | <0.05 | 0.999 | 0.997~1.002 | 0.52 |
| CA72-4 | 1.059 2 | 1.009 0~1.128 2 | <0.05 | 1.006 | 0.994~1.018 | 0.33 |
| PGI | 0.999 1 | 0.991 5~1.006 4 | 0.82 | — | — | — |
| PGII | 1.019 2 | 0.968 6~1.077 4 | 0.46 | — | — | — |
| PGR | 0.923 3 | 0.865 4~0.979 0 | <0.05 | 0.987 | 0.975~0.998 | <0.05 |
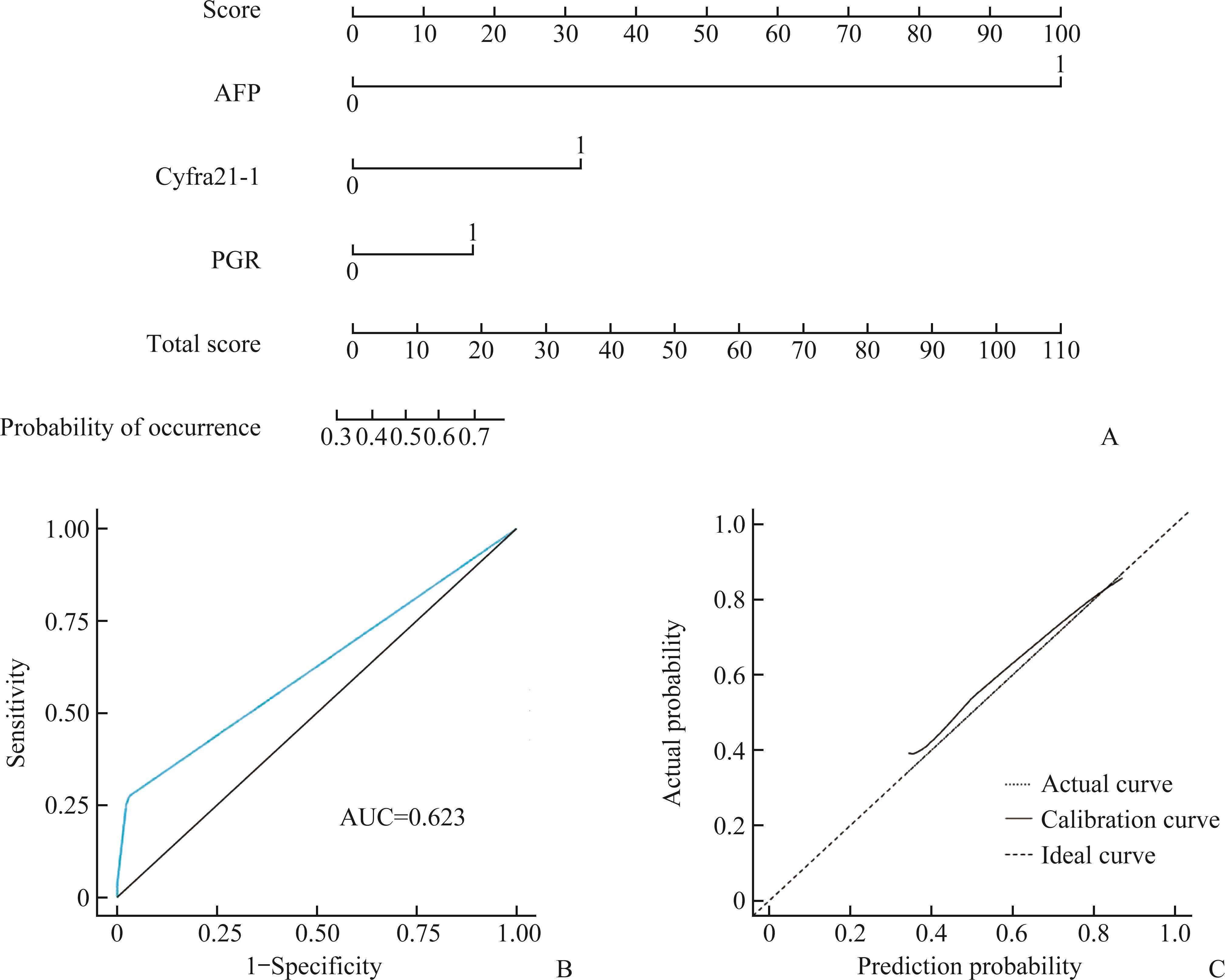
标准临界值下脊柱肿瘤与脊柱感染早期鉴别诊断模型的构建与诊断效能分析
当AFP、cyfra21-1和PGR取标准临界值时,AFP灵敏度为3.3%,准确度为60.2%,cyfra21-1灵敏度为20.9%,准确度为66.1%,PGR灵敏度为2.2%,准确度为59.3%(表3)。构建标准临界值下脊柱肿瘤与脊柱感染的早期鉴别诊断模型,并绘制出列线图(图3A)和ROC曲线(图3B),其AUC为0.623。
| 变量 | 标准临界值下 | 最佳临界值下 | ||||
|---|---|---|---|---|---|---|
| 标准临界值 | 灵敏度 | 准确度 | cut-off值 | 灵敏度 | 准确度 | |
| AFP | 20.0 ng/mL | 0.033(3/91) | 0.602(133/221) | 1.625 ng/mL | 0.692(63/91) | 0.647(143/221) |
| cyfra21-1 | 3.3 ng/mL | 0.209(19/91) | 0.661(146/221) | 1.175 ng/mL | 0.681(62/91) | 0.701(155/221) |
| PGR | 3.000 | 0.022(2/91) | 0.593(131/221) | 11.050 | 0.626(57/91) | 0.575(127/221) |
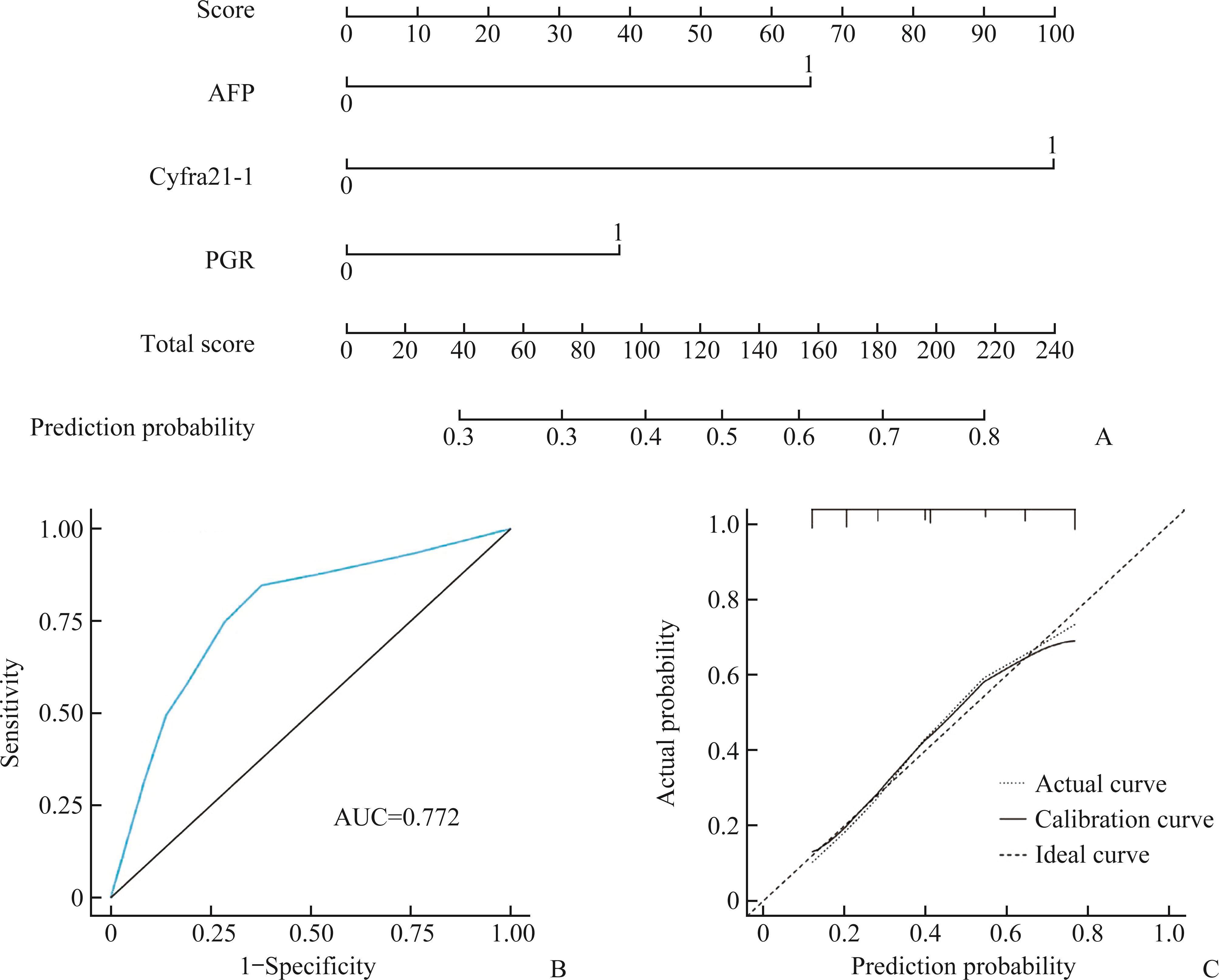
最佳临界值下脊柱肿瘤与脊柱感染早期鉴别诊断模型的构建及诊断效能分析
图1显示AFP、cyfra21-1和PGR的AUC分别为0.696、0.719、0.596,根据约登指数得到各自的cut-off值,AFP取cut-off值为1.625 ng/mL时,灵敏度为69.2%,准确度为64.7%;cyfra21-1取cut-off值为1.175 ng/mL时,灵敏度为68.1%,准确度为70.1%;PGR取cut-off值为11.05时,灵敏度为62.6%,准确度为57.5%。构建最佳临界值下脊柱肿瘤与脊柱感染的早期鉴别诊断模型,绘制出列线图(图4A)和ROC曲线(图4B),其AUC为0.772,并绘制出校准曲线,观察到模型有较好的拟合优度(图4C)。
讨 论
近年来,随着人们生活习惯的改变和人口老龄化的加剧,脊柱肿瘤发病率逐年升高。脊柱肿瘤早期缺乏特征性临床表现[9],与脊柱感染难以鉴别,容易漏诊误诊,影响治疗效果。肿瘤标志物已广泛应用于肿瘤的筛查、诊断、分期和检测复发等,但许多肿瘤标志物的诊断准确性并不高,且其在脊柱肿瘤与脊柱感染早期鉴别诊断中的价值鲜有研究报道。
本研究纳入了中南大学湘雅医院疑似脊柱肿瘤或脊柱感染的骨质破坏患者,剔除不符合诊断标准及有缺失值的数据后,共纳入了221例患者;根据临床最终病理结果,将221例患者分为脊柱肿瘤组91例和脊柱感染组130例,2组患者年龄和性别比较,差异无统计学意义(P>0.05)。对2组患者共10个肿瘤标志物的单因素分析发现,2组CEA、AFP、NSE、cyfra21-1、CA199、CA72-4、PGR的差异有统计学意义(P<0.05);基于各项肿瘤标志物的相关性分析热图显示,CEA与cyfra21-1、CA199、CA125存在很强的正相关性,PGII与PGI、PGR存在很强的负相关性;将所有肿瘤标志物进行单因素logistic回归分析,CEA、AFP、NSE、cyfra21-1、CA199、CA125、CA724、PGR的差异有统计学意义(P<0.05),再将筛选出的8个肿瘤标志物进行多因素logistic回归分析,AFP和cyfra21-1是脊柱肿瘤早期诊断的危险因素(P<0.01),PGR为保护因素(P<0.05)。本研究发现,随着血清AFP和cyfra21-1水平升高,患者诊断为脊柱肿瘤的概率越大,随着PGR的升高,患者诊断为脊柱肿瘤的概率越小。
受肿瘤标志物之间的共线性影响,在单因素logistic回归分析中筛选出的CEA、NSE、CA199、CA125、CA72-4在多因素logistic回归分析中并无统计学意义。当AFP、cyfra21-1和PGR取标准临界值时(AFP<20 ng/mL、cyfra21-1<3.3 ng/mL和PGR>3),AFP灵敏度为3.3%,准确度为60.2%,cyfra21-1灵敏度为20.9%,准确度为66.1%,PGR灵敏度为2.2%,准确度为59.3%。基于AFP、cyfra21-1和PGR构建了脊柱肿瘤与脊柱感染鉴别诊断模型,其AUC仅为0.623。考虑到AFP、cyfra21-1和PGR分别为肝癌、肺癌、胃癌的特异性肿瘤标志物,其标准临界值并不适用于脊柱肿瘤的诊断,尽管其在脊柱肿瘤组与脊柱感染组中的差异有统计学意义,但其阳性率不高。根据约登指数计算得到AFP、cyfra21-1和PGR的最佳临界值分别为1.625 ng/mL、1.175 ng/mL和11.05;取最佳临界值时,AFP灵敏度为69.2%,准确度为64.7%,cyfra21-1灵敏度为68.1%,准确度为70.1%,PGR灵敏度为62.6%,准确度为57.5%,其鉴别诊断模型的AUC为0.772,灵敏度和AUC较选取标准临界值时大幅度提高。
作为细胞角蛋白19的片段,cyfra21-1广泛存在于各种上皮细胞中,且无明显的器官组织特异性,但较AFP和PGR的诊断效能最高。在上皮细胞发生癌变时,cyfra21-1的水平升高,并被释放入组织液中进入血液循环,从而导致血液或尿液中水平明显升高[10]。既往研究认为cyfra21-1主要用于肺癌和膀胱癌的诊断,Fu等[11]报道在卵巢癌、胰腺痛、胃癌、前列腺癌及肝癌中血清cyfra21-1水平也有升高。AFP作为一种致癌糖蛋白,在妊娠期间正常表达,并于1956年首次在人类胎儿中发现。AFP可由卵黄囊、胎儿肝脏和部分胃肠道细胞合成,而成人血清AFP水平的升高通常被认为是异常表现,常被用作卵黄囊肿瘤、性腺源性肿瘤、肝细胞癌和某些胃癌的生物标志物[12]。研究[13-14]表明,PGR是胃癌早期诊断的灵敏指标,其数值变化可以反映胃黏膜的分泌状态和功能。常规实验室检查和影像学检查在脊柱肿瘤与脊柱感染早期鉴别诊断中的特异性不高[15],而血清肿瘤标志物具有其独特的优势,AFP、cyfra21-1和PGR在脊柱肿瘤早期鉴别诊断中具有应用价值。
本研究仍存在一些不足之处,例如在纳入时间范围内仍有一些失访病例及失访数据,因此仍存在潜在的选择偏倚,在后续的研究中将进一步开展多中心的前瞻性研究以验证结论。
综上所述,血清AFP、cyfra21-1升高和PGR降低是早期鉴别诊断脊柱肿瘤的危险因素,但基于3项指标构建的脊柱肿瘤与脊柱感染早期鉴别诊断模型的灵敏度较低。采用新的阈值(AFP<1.625 ng/mL,cyfra21-1<1.175 ng/mL,PGR>11.05)后可以显著提高模型的诊断效能,有助于临床医师对脊柱肿瘤与脊柱感染进行鉴别。
Early detection of cancer: past, present, and future
[J]. Am Soc Clin Oncol Educ Book, 2015: 57-65. https://doi.org/10.14694/EdBook_AM.2015.35.57.Expression of CA125 and cisplatin susceptibility of pleural effusion-derived human lung cancer cells from a Thai patient
[J]. Oncol Lett, 2012, 4(2): 252-256. https://doi.org/10.3892/ol.2012.711.Recent progress in biosensors for detection of tumor biomarkers
[J]. Molecules, 2022, 27(21): 7327. https://doi.org/10.3390/molecules27217327.白细胞、降钙素原和超敏C反应蛋白在超高龄重症患者血流感染的诊断预测价值
[J]. 中华医学杂志, 2019, 99(5): 365-369. https://doi.org/10.3760/cma.j.issn. 0376-2491.2019.05.009.A scoring system for outpatient orthopedist to preliminarily distinguish spinal metastasis from spinal tuberculosis: a retrospective analysis of 141 patients
[J]. Dis Markers, 2021, 2021(1): 6640254. https://doi.org/10.1155/2021/6640254.机器学习和传统列线图预测软骨肉瘤肺转移风险的预测模型的建立与评估
[J]. 中国骨与关节杂志, 2022, 11(1): 19-26. https://doi.org/10.3969/j.issn.2095-252X.2022.01.004.Analysis of the diagnostic efficacy of the QuantiFERON-TB Gold In-Tube assay for preoperative differential diagnosis of spinal tuberculosis
[J]. Front Cell Infect Microbiol, 2022, 12: 983579. https://doi.org/10.3389/fcimb.2022.983579.Tumors of the spine
[J]. World J Orthop, 2016, 7(2): 109-116. https://doi.org/10.5312/wjo.v7.i2.109.Prognostic value of serum cytokeratin 19 fragments (Cyfra 21-1) in patients with non-small cell lung cancer
[J]. Sci Rep, 2015, 5: 9444. https://doi.org/10.1038/srep09444.CYFRA21-1 tests in the diagnosis of non-small cell lung cancer: a meta-analysis
[J]. Int J Biol Markers, 2019, 34(3): 251-261. https://doi.org/10.1177/1724600819868234.AFP (alpha fetoprotein): who are you in gastrology?
[J]. Cancer Lett, 2015, 357(1): 43-46. https://doi.org/10.1016/j.canlet.2014.11.018.胃功能四项在胃癌早期筛查中的意义
[J]. 河北医药, 2021, 43(6): 828-832. https://doi.org/10.3969/j.issn.1002-7386.2021.06.006.Progesterone receptor gene serves as a prognostic biomarker associated with immune infiltration in gastric cancer: a bioinformatics analysis
[J]. Transl Cancer Res TCR, 2021, 10(6): 2663-2677. https://doi.org/10.21037/tcr-21-218.Comprehensive analysis of age-related somatic mutation profiles in Chinese young lung adenocarcinoma patients
[J]. Cancer Med, 2019, 8(4):1350-1358. https://doi.org/10.1002/cam4.1839.作者声称无任何利益冲突。
唐博, 胡小江, 徐东宬, 张广, 张宏其, 郭超峰, 刘少华, 高琪乐, 李艳冰, 唐明星. 血清肿瘤标志物在脊柱肿瘤与脊柱感染早期鉴别诊断中的价值[J]. 中南大学学报(医学版), 2024, 49(9): 1418-1427. DOI:10.11817/j.issn.1672-7347.2024.230603
TANG Bo, HU Xiaojiang, XU Dongcheng, ZHANG Guang, ZHANG Hongqi, GUO Chaofeng, LIU Shaohua, GAO Qile, LI Yanbing, TANG Mingxing. Value of serum tumor markers in early differential diagnosis of spinal tumors and spinal infections[J]. Journal of Central South University. Medical Science, 2024, 49(9): 1418-1427. DOI:10.11817/j.issn.1672-7347.2024.230603
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024091418.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.230603

