长期大规模使用化石能源,大量排放二氧化碳,造成全球气候变暖,给人类的生存和发展带来潜在的威胁。世界各国纷纷发起减少碳排放的号召,中国承诺在2030年实现“碳达峰”,2060年达到“碳中和”[1]。同时,由于化石能源不可再生,寻找可持续的化石能源替代品是新时代能源发展的趋势,对降低化石能源依赖度具有重要意义[2]。氢能作为一种能量载体[3],具有燃烧无污染、热值高、资源丰富以及可再生的特点[4-6],是公认的有效清洁能源之一。氢能在能源领域应用十分广泛,比如氢燃料电池[7]和氢燃料内燃机[8-9]。以氢燃料电池为例,直接将氢的化学能转换为电能,不仅能量转化率高,而且不产生碳排放[10-11]。随着全球能源加速向低碳乃至零碳转型,氢能应用场景日趋多元,其规模化、低成本、高效的制氢技术亟待突破。
随着氢能应用领域的不断拓展,科研者对生产氢气的方法进行了广泛研究。寻求效率高的制氢方法成为氢能领域的研究热点。目前,主要制氢方法如表1所示。其中,天然气制氢可以通过水蒸气重整、部分氧化、自热重整、CH4/CO2重整以及催化裂解等技术,实现大规模制氢[12-16]。但其制氢过程能耗和CO2排放量均较大。煤气化作为天然气制氢中的特例,虽然无CO2排放,但其过程中会产生大量的含硫气体,故环保性较差[14, 17-18]。甲醇水蒸气重整制氢可通过甲醇分解、甲醇部分氧化和甲醇蒸汽重组三种途径实现,整个过程能耗和成本低,产氢率高[19-23]。但甲醇的化学性质活泼,其存储和运输困难,必须依赖特殊的设备来确保其安全性。电解水制氢是一种将电能转化为化学能的环境友好型技术,它不仅能持续产生氢气和氧气,还能实现零碳排放[24-30]。目前,该技术已在工业上应用,但面临电解温度高、制氢效率低、高能耗和高成本的挑战[25, 27]。光催化制氢可利用太阳光作为光源来驱动半导体材料催化水分解产生氢气[23, 31-37]。该技术能直接利用太阳能,且能量转换效率高,能实现零污染排放;但存在催化剂开发和设计困难、制氢效率不高等问题,这极大地限制了其工业化应用[38-40]。生物质制氢可利用植物和农作物残渣等有机物质,在生物或化学反应中产生氢气[41-43]。此方法有利于资源的二次利用,能减少对化石能源生产氢气的依赖。然而,生物质制氢技术不够成熟,面临生产成本高、技术难度大等挑战[44]。
| Renewable | Non-renewable |
|---|---|
Photocatalytic hydrogen production | Natural gas to hydrogen |
| Electrolytic water | Hydrogen from Methanol |
| Biomass to hydrogen | |
Thermochemical hydrogen production |
两步热化学循环制氢可以直接将太阳能转化为化学能(氢能),其能源效率高,是一种备受关注的零碳可持续的制氢技术[45]。两步热化学分解水制氢通过特定的氧化物直接热分解水获得氢气,不需要气体分离步骤,且氧化物材料可以循环利用[46-50]。该方法产生的氢气可直接用作燃料[51]。与其他制氢方法相比[48, 52],两步热化学循环存在以下优点:1) 其制氢过程只需输入热量(太阳能)和水,氧化物材料可循环利用,过程环境友好且可持续;2) 两步热化学循环制氢技术包括热还原和水分解两个过程,分别产生氧气和氢气,其过程安全高效。因此,太阳能热化学循环分解水制氢提供了一条未来可持续生产清洁能源的方式,被认为是非常有前途的生产氢气的途径之一[52-53]。循环材料的活性及稳定性是限制两步热化学循环分解水制氢的关键因素[54]。鉴于目前对不同循环材料在两步热化学循环分解水制氢中的应用缺乏系统性综述,故本文将从循环材料的晶体结构、热力学和动力学等角度,系统综述两步热化学制氢中铈基氧化物、铁基氧化物和钙钛矿等循环材料的研究进展,并对循环材料未来的研究方向进行展望。
1 两步热化学制氢的基本原理
热化学循环分解水制氢包括两步循环、三步循环和四步循环[55]。增加循环步骤可以降低反应的最高温度,提高能量转换效率。但是,随着循环步骤的增加,会导致系统复杂性和成本增加,不利于工业应用[56]。目前,两步循环是热化学分解水制氢领域的主流方向。如图1所示,太阳能两步热化学循环分解水制氢只包含氧化和还原两个步骤,即金属氧化物由高价态变为低价态的还原反应,低价态金属氧化物夺取水中氧原子成为高价态的氧化反应。该过程的反应温度一般为600~2000 ℃。其化学反应过程可以表示如下:
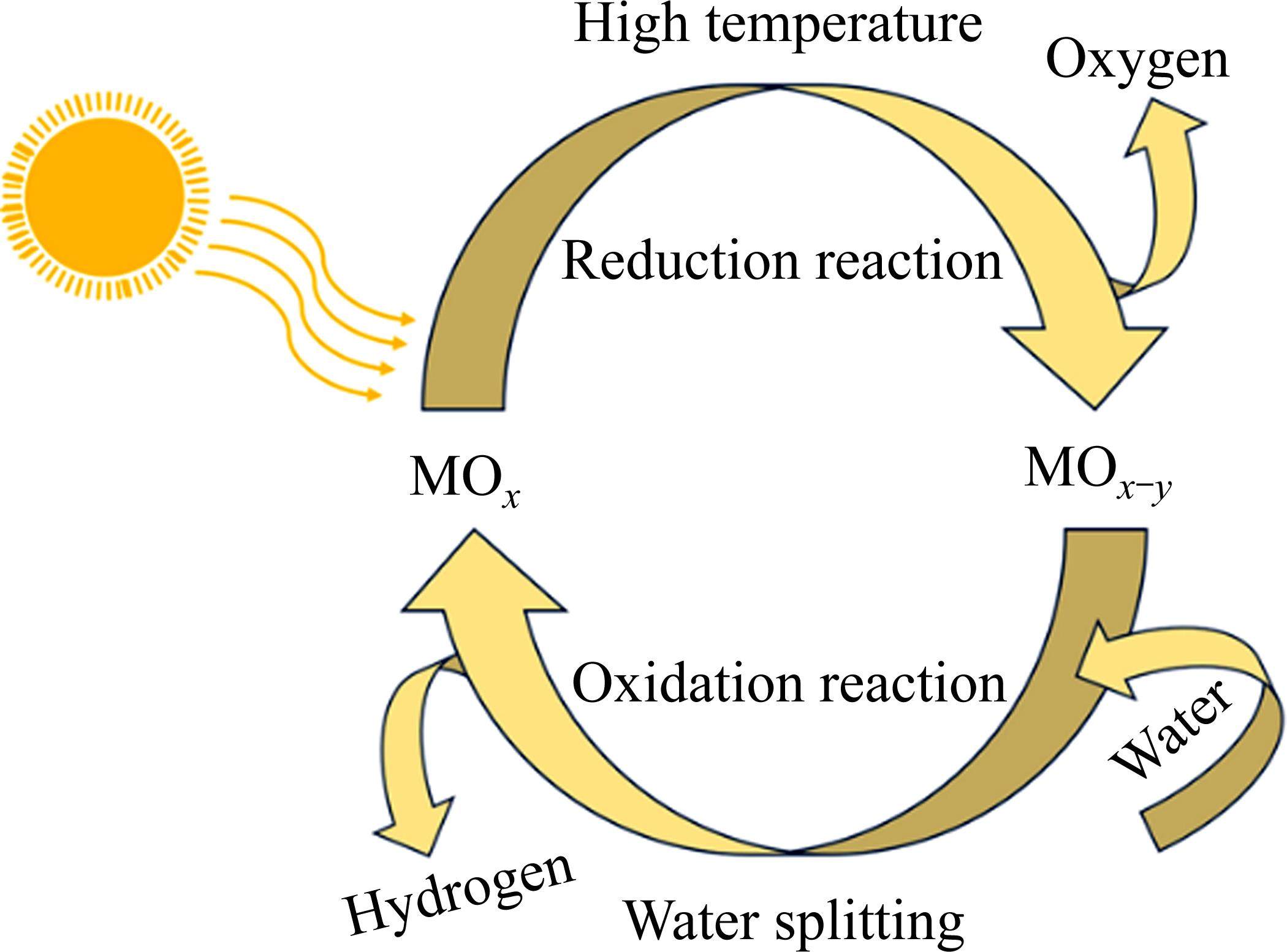
还原反应,
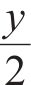
氧化反应,
式中:M表示金属原子;MOx为高价态金属氧化物;MOx-y为相对应的低价态金属氧化物,其中x、y均为常数。
因此,两步热化学循环制氢的工艺流程可概括为两部分:第一部分,金属氧化物作为循环材料,在高温下分解为氧气和次价金属氧化物;第二部分,次价金属氧化物在低于第一部分中分解反应温度下与水反应,产生氢气和高价态金属氧化物(即第一部分中的金属氧化物),这两部分组成热化学制氢的两步循环系统。
2 铈基氧化物材料
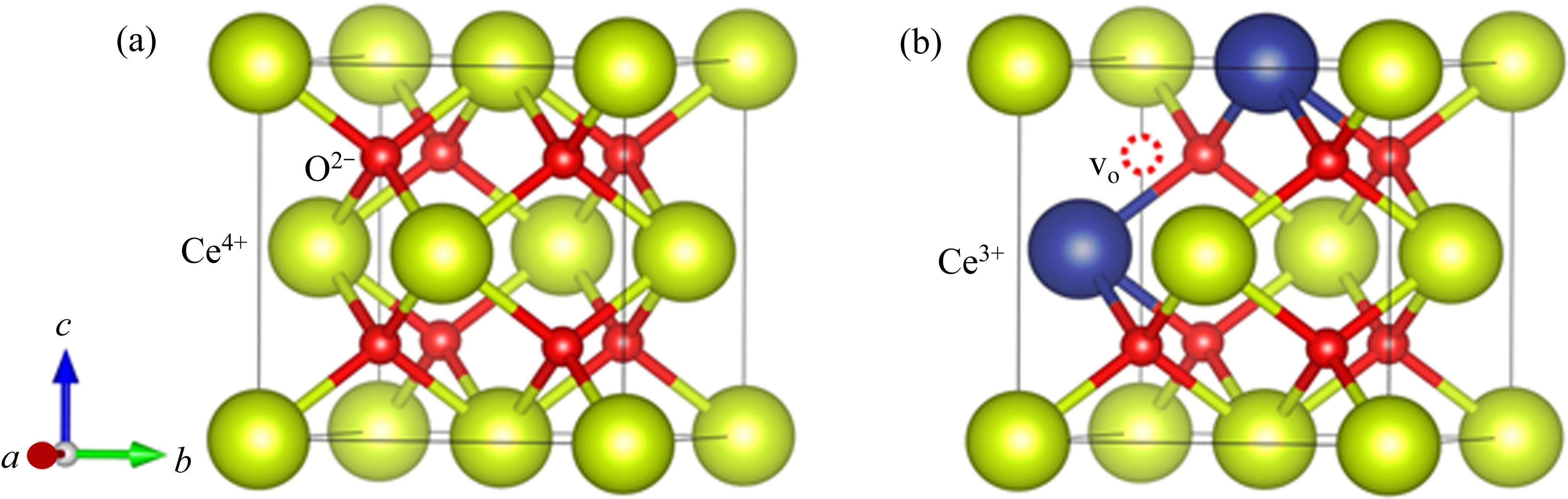
二氧化铈具有立方晶系结构,每个Ce4+的配位数为8,氧离子填充在Ce4+之间(见图2(a))。因氧化铈独特的电子结构使得它更易在Ce4+和Ce3+之间进行可逆电荷转移,形成Ce3+时会产生氧空位(见图2(b))。这些氧空位有助于改善二氧化铈晶格中氧的自扩散和吸附性能,从而促进氧化还原反应的进行[57-58]。铈基氧化物具有丰富的氧空位,被认为是两步热化学制氢方法中非常有潜力的循环材料[59-63]。在这个过程中,铈基氧化物先在较高温度下被激活,释放出氧气;然后在较低温度下分解水,产生氢气。该过程的化学反应为:
还原反应,
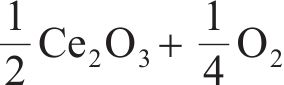
氧化反应,
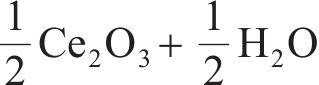
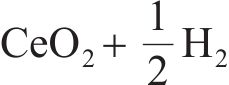
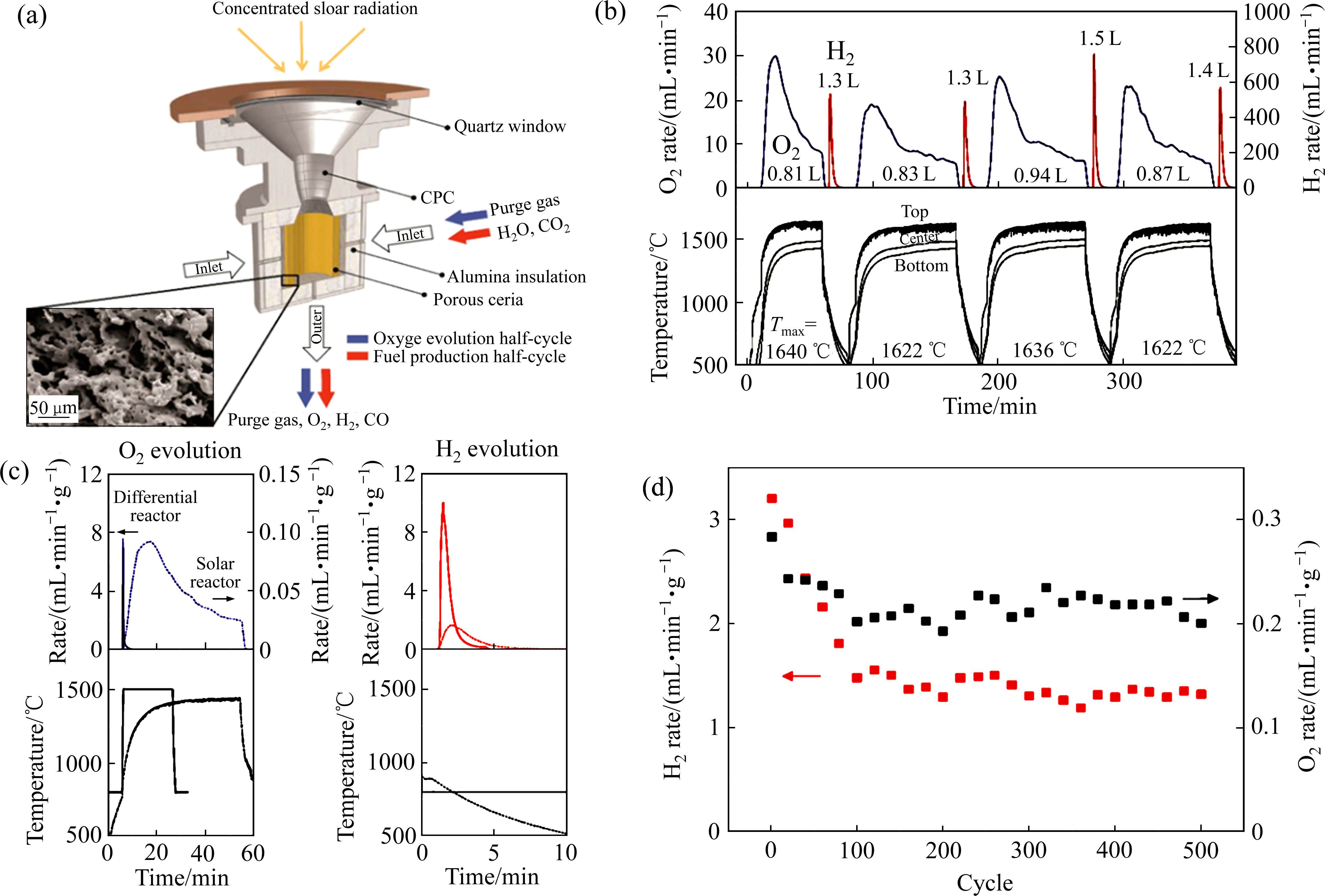
早期,BAMBERGER等[64]研究了铈和碱土磷酸盐反应的热化学分解水的循环过程。首先,在600~1000 ℃条件下,二氧化铈与磷酸、偏磷酸盐和焦磷酸盐的衍生物反应产生氧气和磷酸铈;然后,在700~1200 ℃的条件下,磷酸铈与水蒸气反应产生氢气和二氧化铈。这两个反应过程的实质是铈基氧化物材料中Ce(Ⅲ)的氧化和Ce(Ⅳ)的还原。随后,OTSUKA等[65]从动力学角度研究了二氧化铈在H2气氛中的还原行为,并提出了在低温(573 K)和低压(2.1×103 Pa)条件下,利用含添加剂的铈基氧化物作为催化剂从水中提取氢气。但是,该方法在第一步还原阶段需要使用H2作为还原剂。为简化氧化还原过程和降低制氢成本,人们对铈基氧化物进行了大量尝试,以寻求工艺流程更加简便,且无需消耗还原介质的方法来两步热化学制氢。ABANADES等[51]提出了太阳能热化学循环分解水的方法,将太阳光聚焦到受惰性气体保护的反应器中,达到二氧化铈热解的温度,实现了无介质还原。更重要的是,采用太阳能作为热源可从源头实现两步热化学分解水的零碳排放。因此,基于太阳能的铈基氧化物两步热化学循环制氢成为了研究热点。CHUEH等[61]设计一种由多孔单片圆柱体二氧化铈和隔热腔接收器组成的太阳能制氢反应器(见图3(a)),可以实现较大规模的两步热化学分解水制氢,多孔单片二氧化铈可稳定工作500多个循环。如图3(b)所示,该方法中氢气和氧气的析出速率较快,但是二氧化铈还原的温度较高。与差速反应器对比,太阳能反应器中O2和H2的产生速率和反应温度更具优势(见图3(c))。产生氢气和氧气的瞬时速率在前面100个循环内随着循环圈数的增加稍有下降,在随后的400个循环内基本保持稳定(见图3(d))。总体来说,该研究展示了铈基氧化物循环材料较好的稳定性,但是还原温度过高,会增加过程能耗,导致太阳能转换效率低。
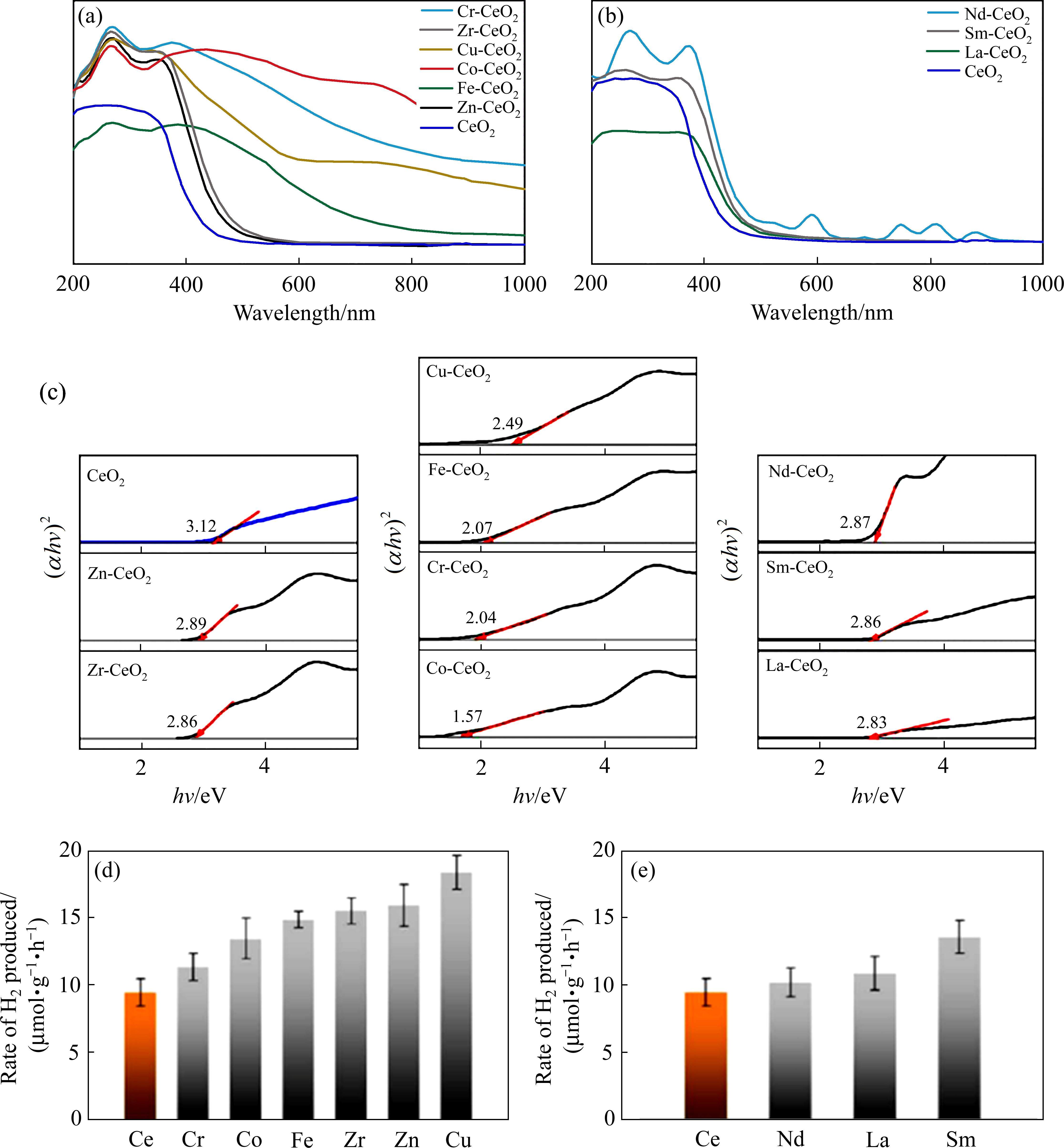
研究者们通过金属阳离子掺杂二氧化铈合成新的铈基氧化物,以引入额外的氧空位或改变晶格结构的方式,不仅促进氧离子传导性和材料表面氧活性,还提高了氢气产率。研究表明[66-68],采用多孔状二氧化铈增大比表面积,能进一步提高二氧化铈的还原率和制氢速率。LI等[69]制备了过渡金属和镧系金属掺杂二氧化铈样品,其对太阳光的吸收性能均得到明显改善(见图4(a)和(b))。金属掺杂二氧化铈样品比纯二氧化铈的带隙(3.12 eV)窄的多,掺杂过渡金属的样品带隙可低至1.57~2.49 eV(见图4(c))。样品带隙越小,相同条件下在太阳光照下产生的电子空穴对越多,产生的氢气也越多。图4(d)和4(e)表明,纯CeO2(未掺杂)的平均H2产率为9.45 μmol/(g·h),而金属掺杂二氧化铈样品的H2产率均在10 μmol/(g·h)以上。特别地,Cu掺杂CeO2样品的H2产率最高可达18.36 μmol/(g·h),接近纯CeO2样品的2倍[70]。因此,通过掺杂过渡金属或镧系金属,可以有效提高铈基氧化物两步热化学循环制氢的效率。除实验研究以外[71-73],学者们还从热力学和动力学角度对铈基氧化物在两步热化学循环制氢中的应用进行理论研究,纯CeO2的结构稳定性大于铁氧化物,且CeO2与MOx(M=Mn,Fe,Ni,Cu)掺杂均可以增加氧空位,提高氢气产量,这与前人研究的实验结果一致。
相同条件下,采用多孔状铈基氧化物,能够增加材料的比表面积,可持续进行反应产生更多的氢气。此外,增加氧空位可加速铈基氧化物中氧的扩散,从而促进反应进行,提高产氢速率。因此,未来可从增加材料的比表面积及氧空位方向努力,以提高氢气产率。
3 铁基氧化物材料
在早期的热化学循环制氢研究中,Fe3O4/FeO是最早被提出的循环材料之一[74-76]。Fe3O4/FeO因热还原阶段稳定性好,且具有非挥发特性,已成为热化学研究中的一个典型循环材料。磁铁矿的两步热化学反应为:
还原反应,

氧化反应,
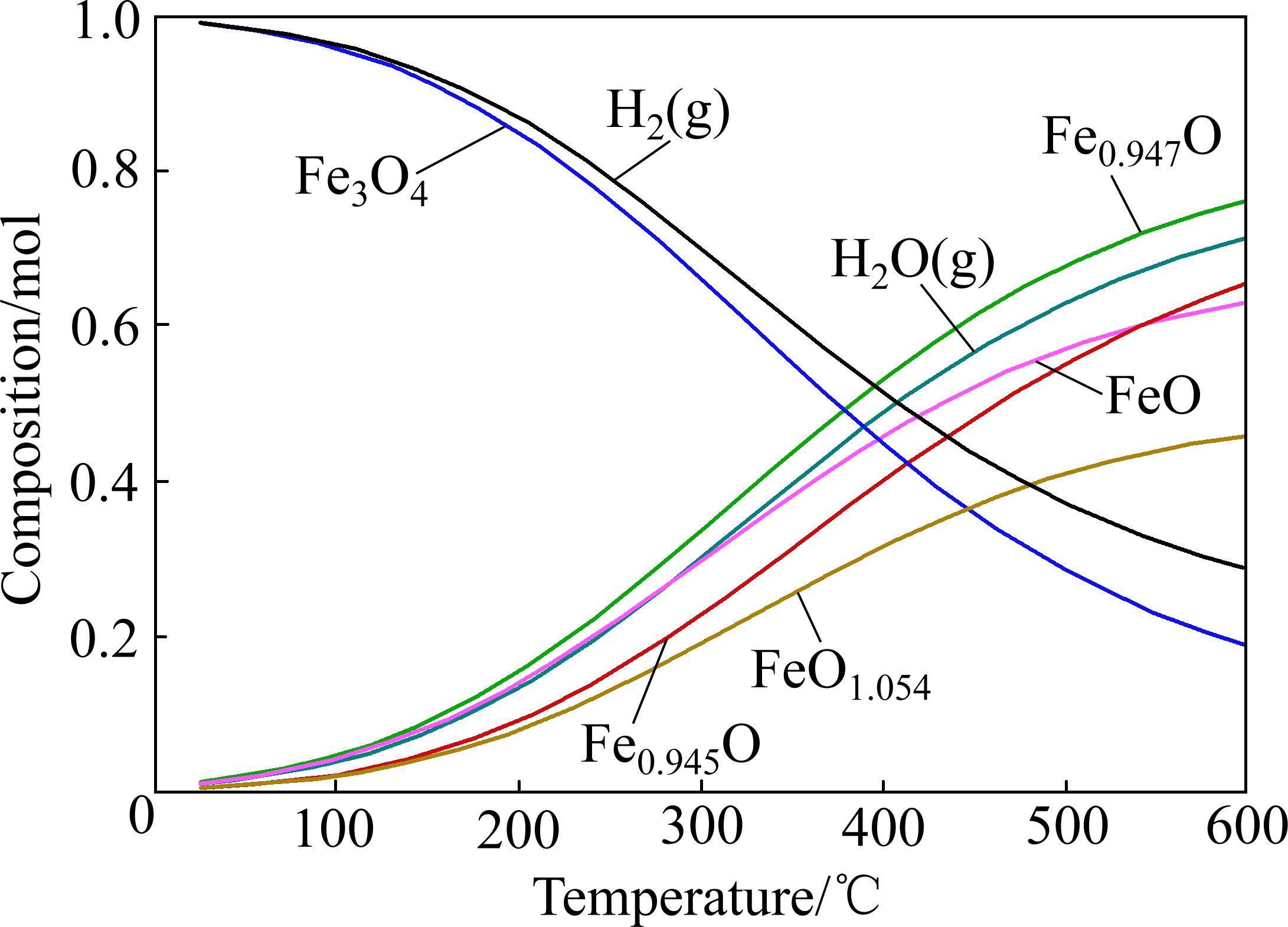
SVOBODA等[77]研究了磁铁矿在高温和混合气体(H2、CO)条件下的还原,以及蒸汽中发生氧化释放氢气的循环过程。研究发现,磁铁矿还原是制备氢气过程中较为困难的阶段。此外,KARATZA等[78]研究了电场、磁场和温度等因素对Fe3O4直接分解水制备氢气的影响,磁场和电场越大,氢气的产率越高。相对于电场和磁场,温度对其分解水的影响是次要的。结合太阳能驱动Fe3O4/FeO氧化还原系统的吸热反应,对FeO/H2O体系进行热力学分析,如图5所示,产生H2的量随温度的升高而降低。这与文献[79-80]结果一致。随着分解水反应的进行,FeO出现显著烧结[81-85],比表面积减小,造成重复循环困难,产氢速率下降,这与KODAMA等[86]的研究结果一致。在数百次中试规模的热化学循环制氢实验中,铁基氧化物表现出比铈基氧化物更差的结构稳定性[87-88]。除氧化物循环材料外,EROGBOGBO等[89]采用激光加热的方式,将SiH4热解为纳米硅,在无光、电和热的辅助条件下,纳米硅(10 nm)分解水生成氢气的速率比块状硅高1000倍。但纳米硅分解水过程中会生成一层二氧化硅附着在硅的表面,从而阻碍反应进行。
同时,学者们对铁基氧化物材料进行热力学计算研究[90-91], Fe3O4的分解温度超过其沸点,因此采用金属掺杂形成尖晶石铁酸盐以降低分解温度。虽然材料的分解温度降低了,但其烧结问题仍存在。针对两步热化学循环制氢中循环材料烧结的问题,不少学者将ZrO2负载的铁氧化物进行探索[92-97]。研究发现,ZrO2的加入不仅降低了分解水制氢过程中材料的团聚,而且还提高了材料表面活性,从而促进氢气产生[52]。因此,对于铁基氧化物材料,通过掺杂的方式可增加其表面积,减少材料的团聚,增加材料的循环次数,进一步提高产氢量。循环材料烧结团聚的情况虽有所改善,但并未从根本解决问题。因此,寻找稳定性好、高活性、氧空位充足和比表面积大的热化学制氢循环材料是非常有必要的。
4 钙钛矿材料
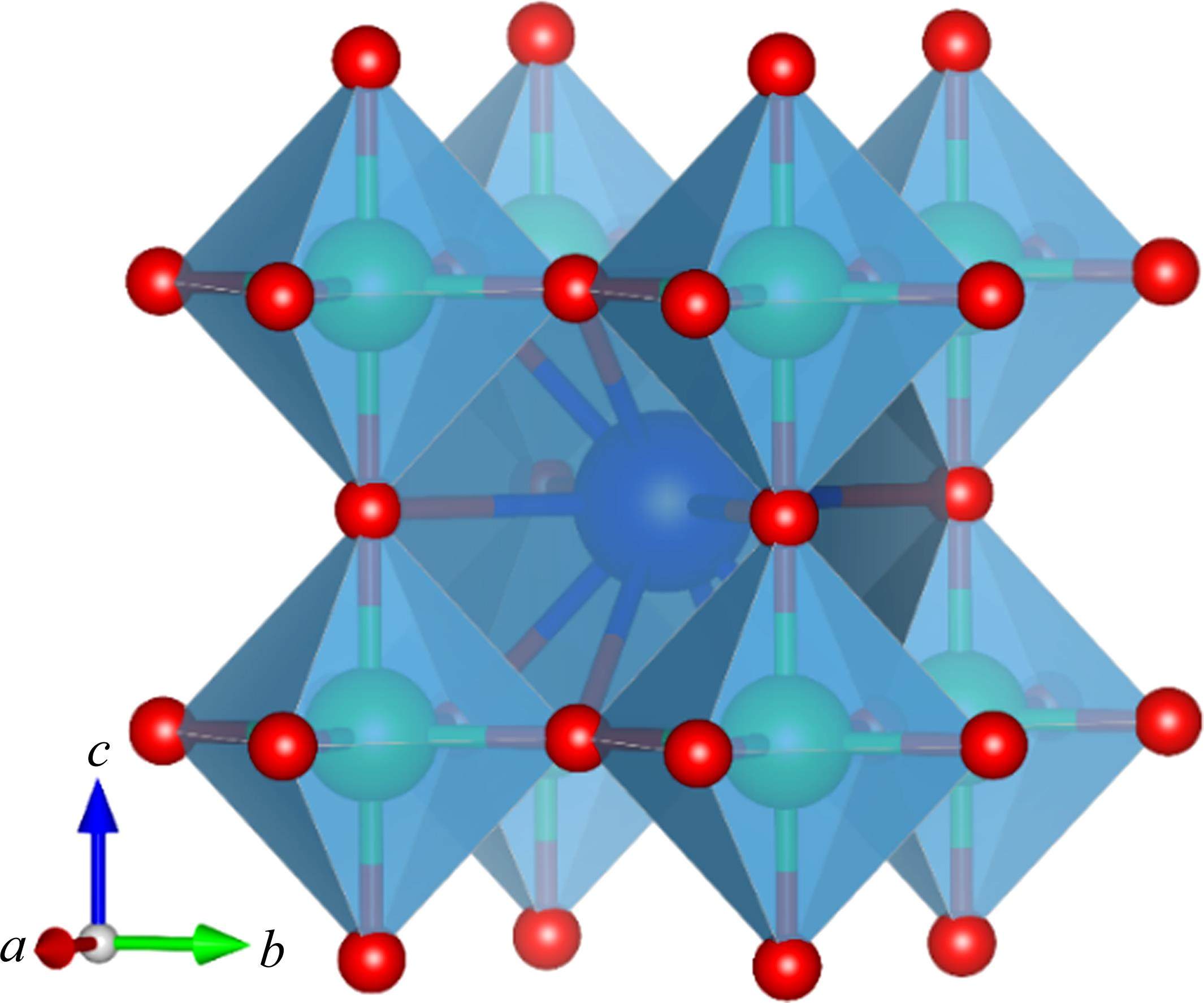
传统的太阳能热化学循环制氢材料由于结构组成空间有限,无法将热力学、动力学及相稳定性能同时发挥到理想状态[98]。因此,寻求一种能够满足当前太阳能热化学制氢所需的循环材料是至关重要的。而钙钛矿作为一种新兴材料,在能源、光电子、光学和传感器等领域应用广泛[99-104]。钙钛矿是一种由至少两种不同金属元素和氧组成的化合物,化学式为ABX3。其中,钙钛矿型氧化物的化学式一般为ABO3[105-106]。如图6所示,钙钛矿晶体结构为立方相,A点位通常是位于整个立方体的中心的较大阳离子,B点位是形成晶胞的中心的较小阳离子,氧离子占据立方体的顶点。这种结构使得其具有特殊的稳定性[107-109],能够满足太阳能热化学制氢中对循环材料的需求。
钙钛矿结构中,通过将A、B位置的金属进行不同组合,以改变氧化还原焓和熵[110],从而改变钙钛矿的热力学性质。而重新组合后的钙钛矿获得高晶格的氧离子扩散速率,有利于热化学循环过程中氧化还原动力学的快速进行[83, 111]。此外,钙钛矿氧化物热膨胀系数通常相对较低[112-114],意味着在高温下,其晶体结构不易发生显著变形,能够保持原有的晶体结构和性能特征,表现出较好的稳定性,这些优点也使其在太阳能热化学循环制氢中具有较大的应用潜力。其化学反应方程式为[115]:
还原反应,
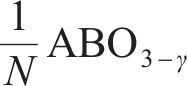
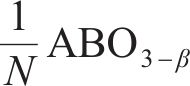
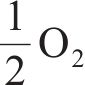
氧化反应,
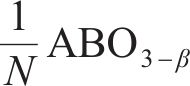
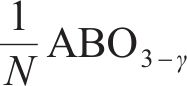
式中:γ、β分别为还原半循环开始和结束时氧原子的非化学计量值,N=β-γ,为整个循环过程中氧原子非化学计量值的变化。
为探索钙钛矿材料在太阳能热化学循环制氢中的应用潜力,学者们在理论计算方面进行众多研究[116-121]。VIETEN等[110]提出一种适用于太阳能热化学循环制氢的钙钛矿固溶体材料设计方法,并基于密度泛函理论,计算了240多种钙钛矿到还原产物相的氧化还原焓,其值为340~706 kJ/mol,其中超过50%的氧化还原焓为50~400 kJ/mol,这与钙钛矿在热化学循环制氢中的应用密切相关。CARRILLO等[118]建立了热力学过程模型来预测钙钛矿(La1-x(Sr,Ca)xMn1-yAlyO3)将太阳能转化H2的效率,并与纯二氧化铈进行比较。在等温条件下,La0.6Sr0.4Mn0.6Al0.4O3和CeO2将太阳能转化H2的效率分别为35.17%、28.26%,La0.6Sr0.4Mn0.6Al0.4O3生产H2的效率优于CeO2。除理论研究外,BARCELLOS等[122]对一种很有热化学循环制氢应用潜力的钙钛矿(BaCe0.25Mn0.75O3-δ/BCM)进行实验研究,采用分段式加热(电加热到氧化温度,再由激光加热到还原温度)进行分解水制氢。图7(a1)和(a2)给出BCM、CeO2材料分别进行两个完整的水分解循环数据。在刚开始的热分解过程中,受动力学和热力学的限制,BCM比CeO2释放的O2多,但在第二个水分解循环中,BCM的O2释放量(65 μmol/g)明显少于第一个循环(82 μmol/g)。BCM在氧化步骤的H2释放量达到了140 μmol/g,CeO2是50 μmol/g,BCM接近CeO2的3倍。对于BCM的循环稳定性,如图7(b)和(c)所示,BCM进行分解水制氢的50个循环中产生H2的速率及H2、O2的总量基本保持不变,充分表明 BCM在两步热化学循环制氢中的稳定性能优异。

WANG等[123]合成了钙钛矿La1-xCaxMn1-yAlyO3(x, y=0.2, 0.4, 0.6或0.8),并从中筛选出性能优异的热化学循环制氢钙钛矿材料(La0.6Ca0.4Mn0.6Al0.4O3/LCMA-C0.4A0.4),其XRD谱如图8(a)所示。可以看出其衍射峰为典型正交钙钛矿结构,与文献[124]一致。样品表面由众多小颗粒连接的分层多孔状结构(见图8(b))组成,且金属阳离子的分布比较均匀(见图8(d)),粒径在20 nm左右(见图8(c))。钙钛矿LCMA-CxA0.4中Ca的掺杂水平与H2生成速率密切相关。如图8(e)所示,Ca的掺杂水平由0.2升至0.4时,H2生成速率有所提高,这从动力学角度表明Ca的掺杂有利于加快反应进行;当Ca的掺杂量由0.4继续提高至0.8时,H2生成速率反而下降。且相同条件下,LCMA-C0.4A0.4生成H2的量为 429 μmol/g,是二氧化铈的8倍。由此得知,钙钛矿材料在两步热化学循环制氢时,效率高且连续循环性能优异。
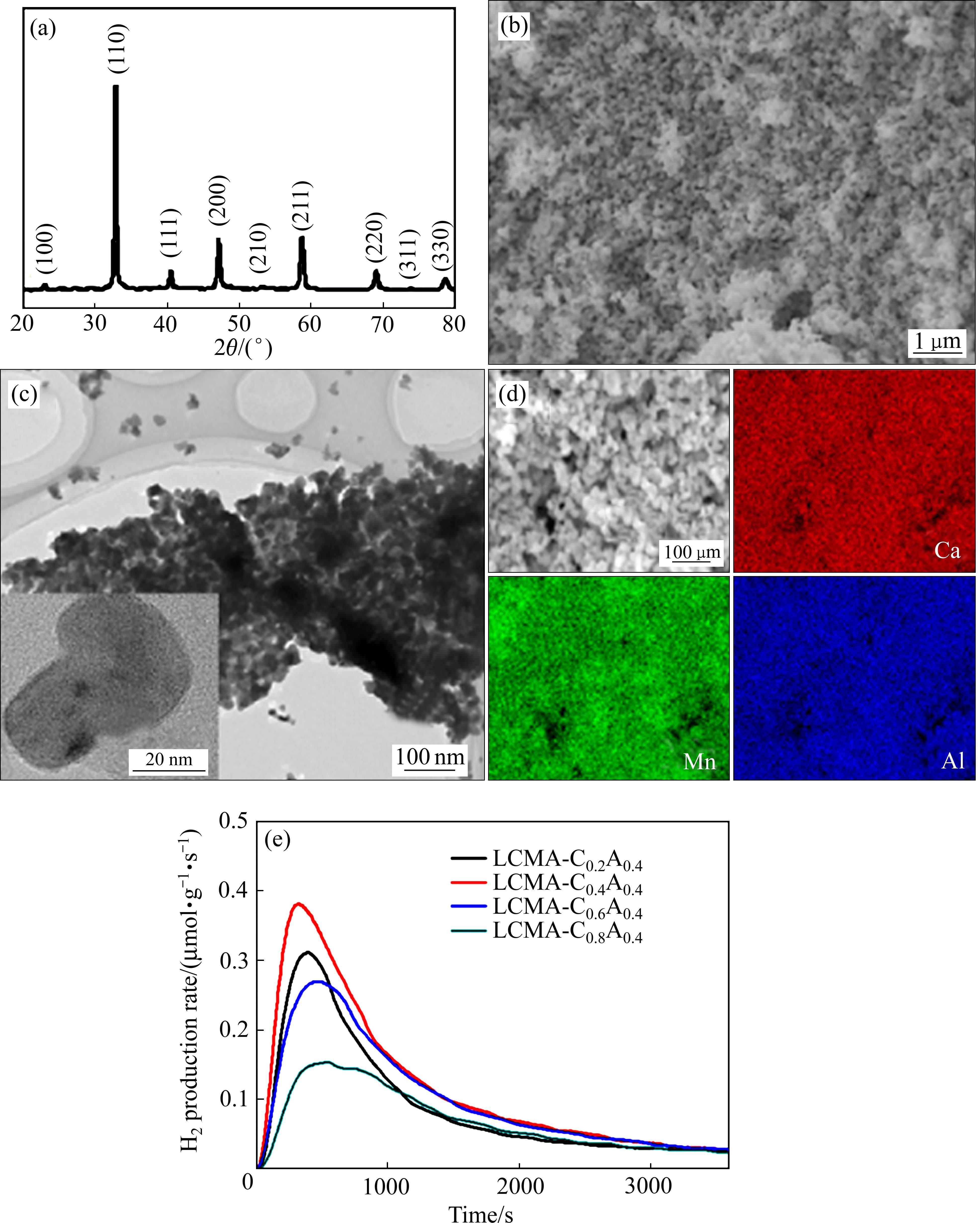
相比其他材料,钙钛矿在产氢效率和重复循环方面具有较好的表现。但随着温度和循环次数的增加,几乎所有两步热化学循环制氢材料都会存在团聚现象[125]。为进一步提升钙钛矿在两步热化学循环制氢中的性能,通过金属掺杂进一步增加材料表面氧空位[126-127],调整钙钛矿的电子结构[128],以及酸刻蚀对钙钛矿表面进行改性处理等方式[129],均可提高钙钛矿材料氧化还原过程的表面氧活性,从而进一步提高材料的重复循环性能,以最终达到产氢量高的目的。此外,还可以降低两步热化学循环制氢中热还原和分解水两个阶段的温度差,以实现等温热化学还原[130]提升钙钛矿在两步热化学循环制氢中性能的目的。
5 结论与展望
目前,全球低碳经济发展的趋势下,氢气在化工和能源行业得到了广泛应用,采用经济环保的方法生产氢气势在必行。太阳能两步热化学循环制氢不仅能够利用可再生资源完成能量的存储和转化,而且全程无污染排放。几十年来,人们对太阳能两步热化学循环制氢进行了大量的研究,而循环材料是需要解决的核心问题。本文综述了以铈基氧化物、铁基氧化物和钙钛矿氧化物作为循环材料的两步热化学循环制氢的研究进展。增加循环材料的比表面积和氧空位有利于促进两步热化学循环制氢反应的可持续性,增加产氢量。另外,金属掺杂也能降低第一步还原反应的温度,增加材料的氧空位,减少循环材料团聚问题,加快反应进行。
尽管两步热化学循环制氢具有巨大应用潜力,但是高性能的金属氧化物循环材料在未来的开发应用中仍存在挑战。未来可以改进的地方:一方面,经过表面改性处理(酸刻蚀)和创新合成新方法调控循环材料的微观组织结构,增大循环材料的比表面积,改善产氢速率;另一方面,开发多功能复合材料,增加循环材料的氧空位,提高循环材料的活性和连续循环稳定性或者寻找一种更适合两步热化学循环制氢的新型金属氧化物来代替当前的循环材料。
张晓虎, 李光石, 程鹏, 等. 两步热化学制氢循环材料的研究进展[J]. 中国有色金属学报, 2025, 35(1): 18-33. DOI: 10.11817/j.ysxb.1004.0609.2024-44996
ZHANG Xiaohu, LI Guangshi, CHENG Peng, et al. Advances in two-step thermochemical hydrogen production cycle materials[J]. The Chinese Journal of Nonferrous Metals, 2025, 35(1): 18-33. DOI: 10.11817/j.ysxb.1004.0609.2024-44996

