钒是我国重要的战略资源,广泛用于冶金、化工、国防、医学、新材料等领域[1-3],随着我国航空航天、海洋工程、储能等领域的快速发展,钒的应用和需求将不断扩大[4]。钒渣是最主要的工业提钒原料,全球80%以上的钒产品以钒渣为原料制备而得[5]。目前,钒渣提钒主要有钠化焙烧—水浸或钙化焙烧—酸浸两种工艺,钠化焙烧工艺存在添加剂成本高、氨氮废水处理难度大、副产硫酸钠、钒铬污泥治理困难等问题[6-8]。相比之下,钙化焙烧工艺具有添加剂成本低、废水处理简单、无难处理固废等优点,工业应用前景广阔[9]。然而,钙化焙烧工艺对钒渣物相组成及焙烧参数要求比较苛刻,存在钒转化率偏低的缺点,加上浸出和洗涤不充分等问题,提钒尾渣中往往含有1.5%~3.0%的V2O5[10],导致钒收率偏低。因此,开发基于提钒尾渣的深度提钒工艺,对提高钒资源利用效率、促进钒产业绿色低碳制造,具有重要的战略意义及现实需求。
针对提钒尾渣中钒资源回收,已有的研究主要集中在还原熔炼制备含钒铁合金及湿法酸浸两类工艺[11-17]。提钒尾渣还原熔炼的原理为采用还原剂(如C)将其中的钒、铁、铬、锰等金属元素转化为多元铁合金(钒含量约为3%,质量分数),具有流程短、处理效率高的优势,但是,该方法需要对提钒尾渣进行脱硫、造粒、干燥预处理,导致成本增加,且制备出的合金硫、磷等杂质成分含量高,难以用于后端合金制造[11-12]。相比之下,采用湿法酸浸工艺能够在较低的能耗条件下,实现尾渣中钒的短流程、低成本高效提取。邓志敢等[13]、樊刚等[14]分别采用硫酸浸出提钒尾渣,在较优的条件下,钒的浸出率最高可达85%以上。然而,提钒尾渣中含钒物相的酸浸热力学选择性尚缺乏研究,为了提升钒的浸出率,通常向浸出体系中加入HF或其他含氟化合物作为助浸剂,容易造成酸耗增加、设备腐蚀、浸出残渣利用困难等问题;更重要的是,HF等助浸剂容易将提钒尾渣中的硅酸盐、赤铁矿、铁板钛矿等物相溶解,导致酸溶选择性变差,浸出液中铁、磷、硅、钛含量高,后续分离纯化难度大,难以制备出合格的氧化钒产品[15-17]。因此,亟待开发钙化提钒尾渣中钒的深度提取新方法,解决尾渣中钒的高效选择性提取及利用关键问题,以支撑提钒尾渣绿色低成本提钒技术开发与应用。
本文提出了钙化提钒尾渣低pH值浸出—浸出液碳酸氢铵除杂新方法,通过低pH值酸浸将尾渣中的钒选择性提取至溶液,再以碳酸氢铵除杂,降低浸出液中铁、磷杂质浓度,最后通过酸性铵盐沉钒、煅烧得到合格的五氧化二钒产品。针对尾渣中钒浸出效率及钒溶液纯化关键问题,开展了尾渣物相组成及元素微观分布表征,考察了浸出及纯化条件对钒回收利用的影响,获得了较优的工艺控制参数,可为钒渣提钒尾渣中钒资源的低成本、高效清洁利用提供支撑。
1 实验
1.1 试验原料
提钒尾渣取自西昌某钒厂,其主要化学成分如表1所示。实验所用硫酸、碳酸氢铵均为分析纯 (成都科龙化工试剂厂),所用去离子水为实验室自制,实验过程的其他化学药品均为分析纯且未经进一步纯化。
| V2O5 | Cr2O3 | Fe2O3 | TiO2 | MnO | CaO | MgO | Al2O3 | P |
|---|---|---|---|---|---|---|---|---|
| 2.95 | 2.07 | 40.71 | 10.53 | 4.26 | 10.14 | 1.56 | 1.25 | 0.05 |
1.2 试验方法
提钒尾渣酸浸:首先将提钒尾渣磨至45 μm以下,取50 g尾渣,按照设定的液固比,将尾渣置于装有去离子水的烧杯中,将烧杯置于设定温度的水浴锅中,在转速400 r/min下向烧杯中加入体积比1∶1的硫酸,按设定参数控制反应过程pH值;反应达到预设时间后,停止加酸及搅拌,过滤浸出料浆,并将滤饼烘干、称取质量,通过式(1)计算钒的浸出率:
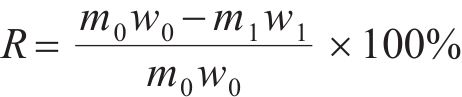
式中:R为钒的浸出率,%;m0、w0分别为尾渣质量(g)及尾渣中钒的含量;m1、w1分别为尾渣经过酸浸后残渣的质量(g)及残渣中钒的含量。
酸浸钒液除杂:向得到的钒浸出液中加入碳酸氢铵调节pH值进行除杂,考察除杂pH值对浸出液中铁、磷杂质浓度的影响。
五氧化二钒产品制备:将除杂后的钒溶液加酸调节pH值至1.8~2.0,再加热到100 ℃,保温60 min进行沉钒,沉钒结束后过滤、洗涤得到多钒酸铵沉淀,经100 ℃干燥2 h,再于520 ℃煅烧120 min,获得V2O5产品。
1.3 表征方法
提钒尾渣、五氧化二钒产品及钒溶液的化学成分由化学滴定法和ICP-AES(ZSX Primus II,日本)分析,提钒尾渣的物相组成由配备了Cu靶 Kα的X射线衍射仪测定(XRD,PANalytical,荷兰),测定结果由X' Pert HighScore Plus软件进行分析。尾渣的形貌及元素微观分布由扫描电镜-能谱仪分析(SEM-EDS,SIGMA500,德国)。
2 结果与分析
2.1 尾渣中V的赋存状态
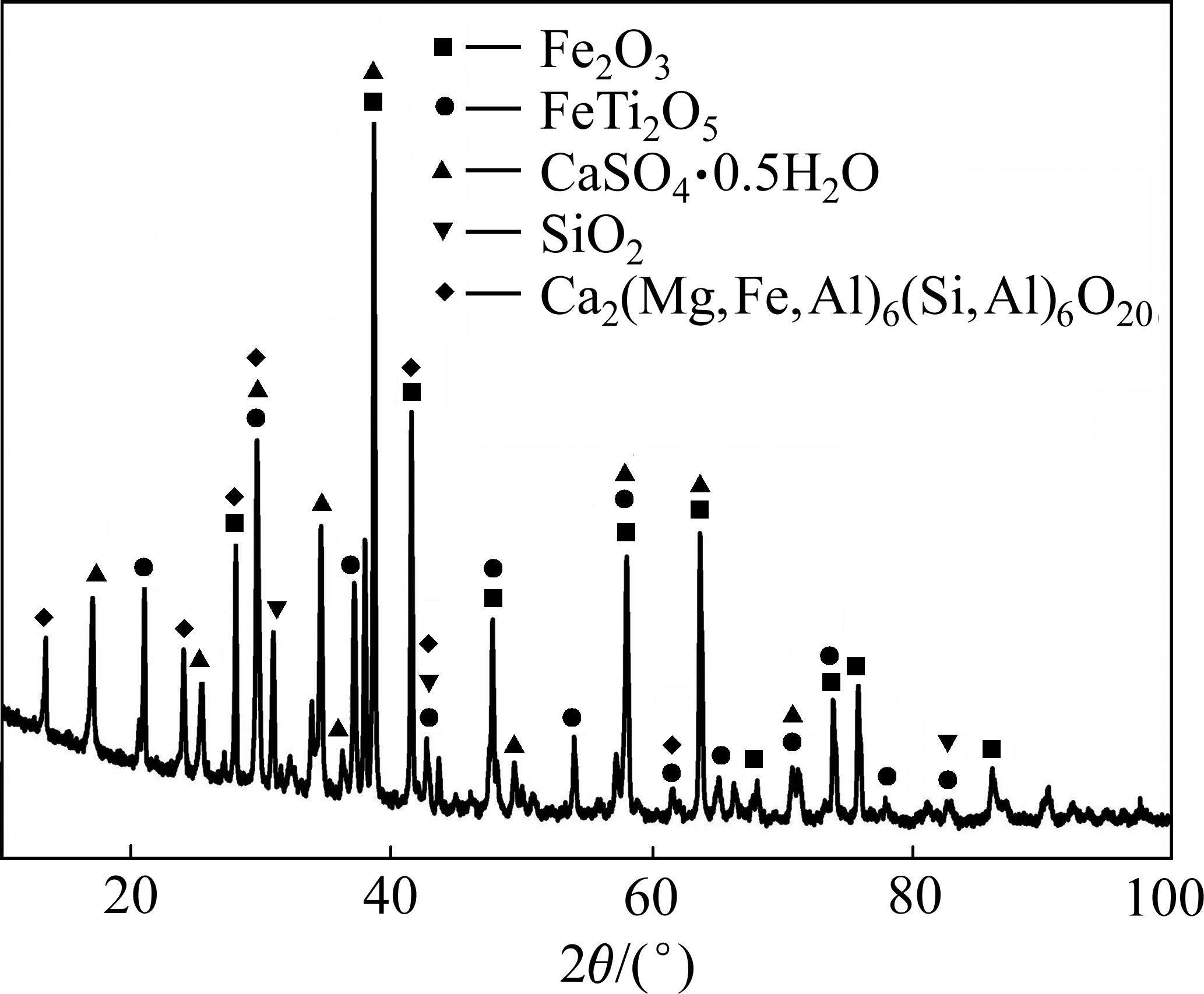
首先对钒渣钙化提钒尾渣的物相组成及元素微观分布进行表征,结果分别如图1~3和表2所示。由图1可知,提钒尾渣主要由赤铁矿(Fe2O3)、铁板钛矿(Fe2TiO5)、半水硫酸钙(CaSO4·0.5H2O)及氧化硅(SiO2)、硅酸盐(Ca2(Mg, Fe, Al)(Si, Al)6O20)组成。由图2可知,提钒尾渣呈现出多孔状态,钒主要与钙、锰、铁、钛呈现出相似的微观分布状态,硅则主要与钙、铝等元素呈现出相似的分布规律,说明钒主要赋存在含铁、钛及钙、锰的物相中。进一步通过EDS点成分分析,结合图1,发现V在赤铁矿(见图3和表2中点1、2),铁板钛矿(见图3和表2中点3)、硅酸盐(见图3和表2中点4)及焦钒酸钙/锰相(见图3和表2中点5,n(Ca+Mn)/n(V)约为1)均有分布,其中,焦钒酸钙/锰相中的钒含量最高,而铁板钛矿相中同样赋存了较高含量的钒。结合文献[18-19]报道可知,分布于铁板钛矿中的钒主要为V3+或V4+,而钒酸钙/锰中的钒则主要是V5+。值得一提的是,硅酸盐相中锰、铁含量较高,说明在被硅酸盐包裹的钒酸锰或Fe2O3中也赋存有钒。
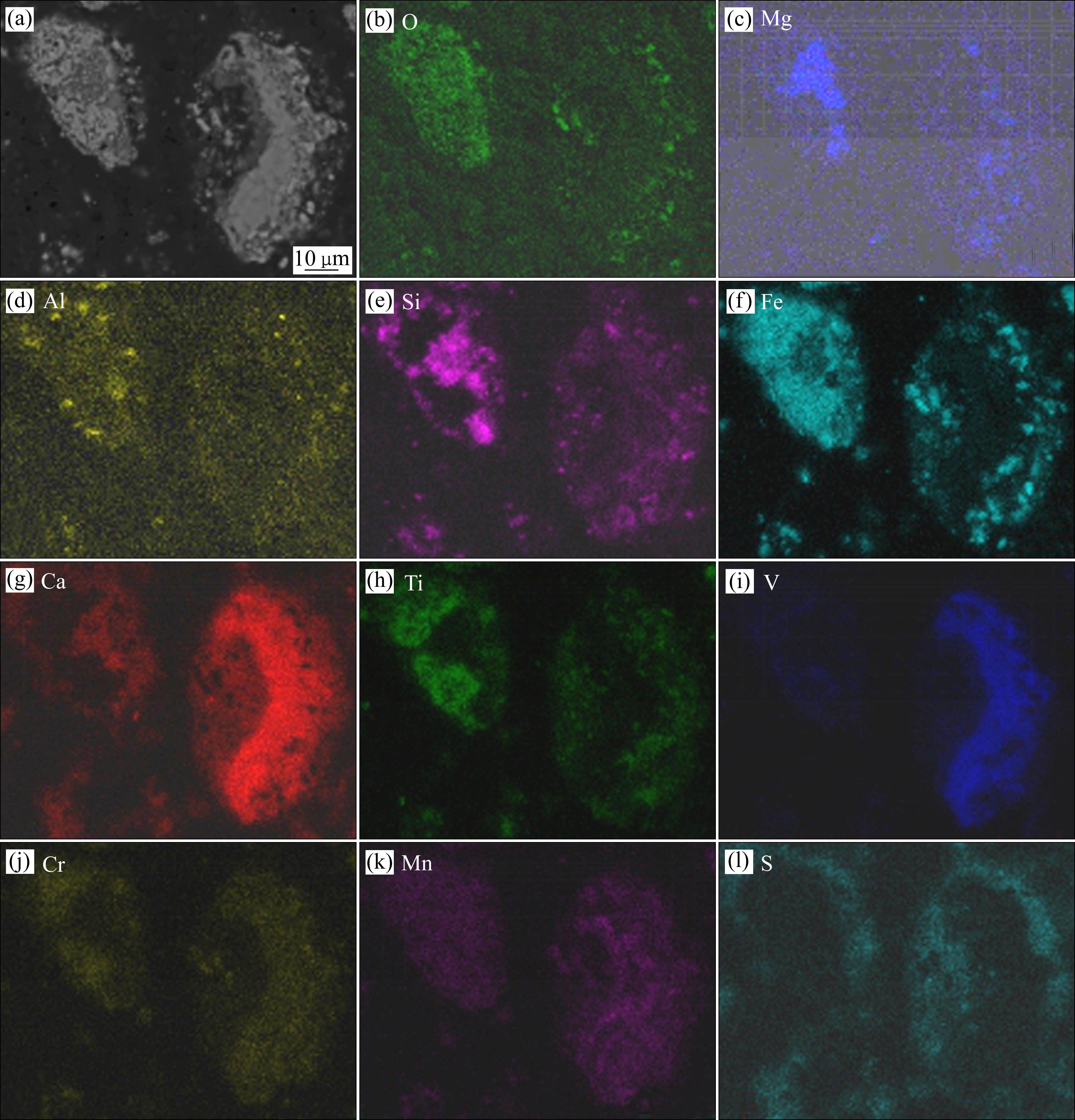

Point No. | Mass fraction/% | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| V | Fe | Ti | Mn | Ca | Mg | Al | Si | O | |
| 1 | 1.37 | 72.17 | 1.26 | 1.98 | 1.03 | - | - | - | 22.19 |
| 2 | 1.19 | 57.96 | 2.02 | 3.73 | 0.97 | 2.49 | 2.40 | 1.74 | 27.50 |
| 3 | 4.09 | 42.21 | 18.56 | 3.19 | - | 2.62 | 2.53 | - | 22.20 |
| 4 | 1.68 | 21.01 | 2.09 | 7.52 | 6.43 | 4.05 | 2.34 | 26.76 | 28.13 |
| 5 | 37.81 | 2.50 | - | 4.30 | 28.63 | - | - | 2.91 | 22.43 |
2.2 提钒尾渣硫酸浸出的热力学分析
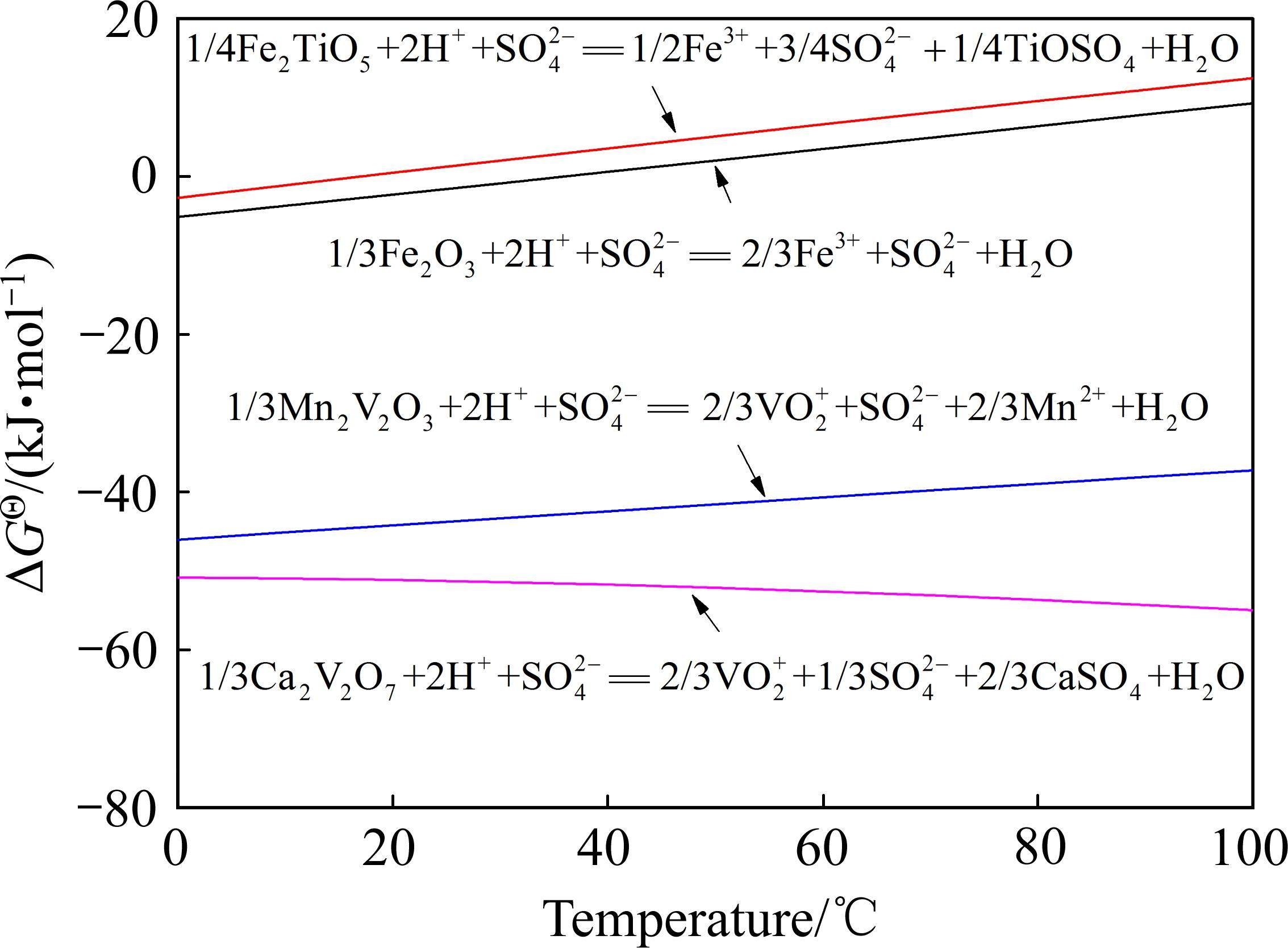
基于提钒尾渣的物相及元素微观分布表征结果,查阅热力学数据,对提钒尾渣中主要含钒物相酸浸反应的热力学可行性进行了分析,每个反应固定H2SO4的量为1 mol[20],结果如图4所示。由图4可知,渣中的含钒物相与硫酸反应的
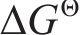
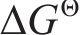
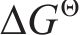
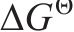
2.3 酸浸pH值对钒浸出率的影响
基于提钒尾渣酸浸的热力学分析结果,开展了提钒尾渣酸浸提钒试验研究,首先考察了浸出pH值对尾渣中钒浸出率的影响规律,其中,浸出温度为室温(25 ℃左右),液固比为1.5∶1,浸出时间30 min,搅拌速率400 r/min,结果如图5所示。
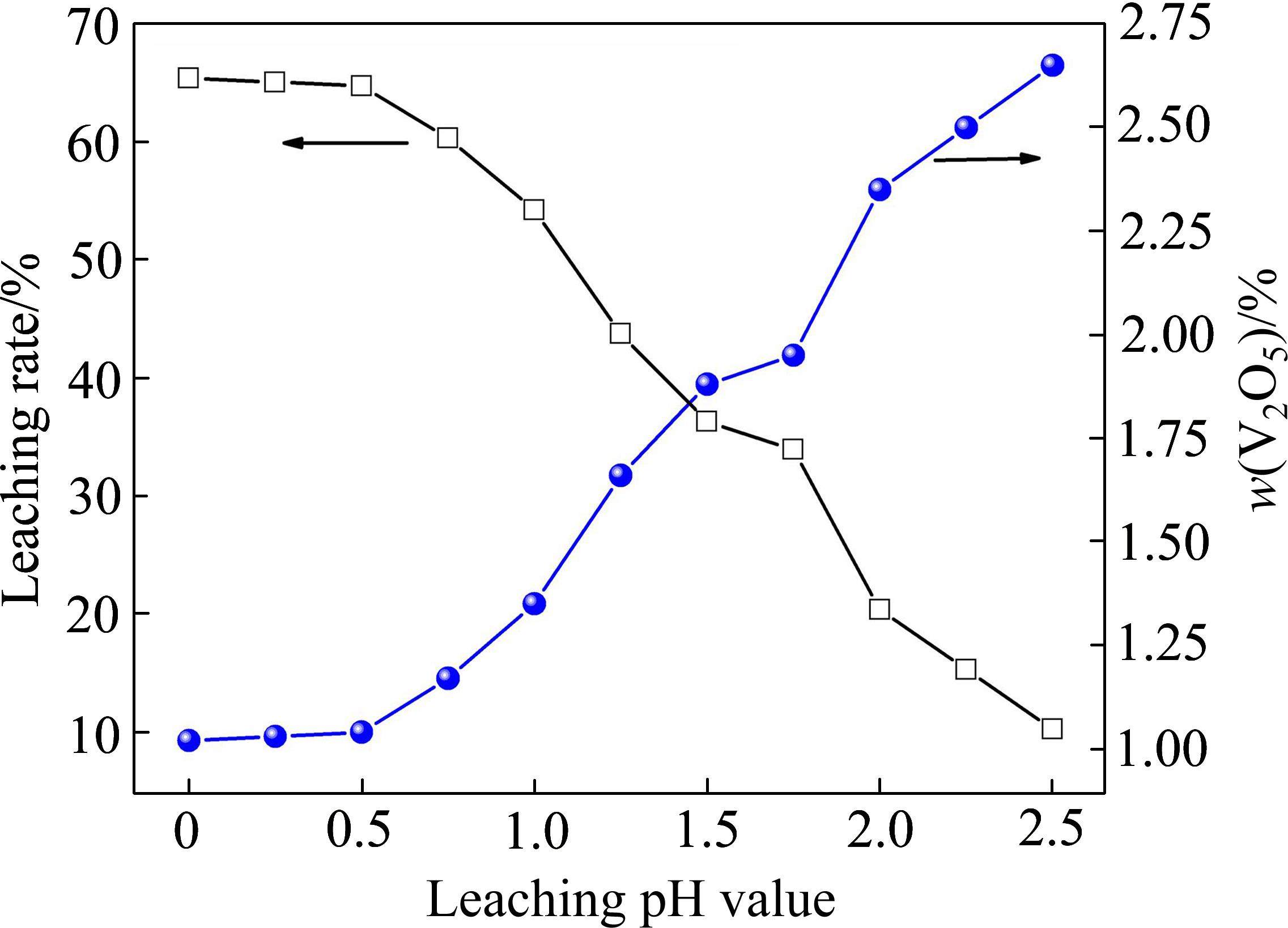
由图5可知,随着酸浸pH值逐渐升高,尾渣中钒的浸出率呈现降低的趋势,尾渣钒的含量则呈现升高趋势。其中,当pH值由0升至0.5时,钒的浸出率随pH值升高几乎不发生变化;而当pH值由0.5升至2.5时,钒的浸出率随pH值升高呈现出急剧降低的趋势。作为典型的液固反应,浸出pH值主要反映H2SO4浓度的变化,而硫酸作为酸浸反应物之一,当其反应级数一定时,其浓度越低,将会导致酸溶反应速率降低,最终使钒的浸出率降低[21]。因此,在pH为0~0.5时,溶液中H2SO4浓度能够确保较优的酸溶反应动力学,而pH值在0.5~2.5区间时,酸溶反应动力学速率随H2SO4浓度降低急剧降低。同时,图5中钒的浸出率随pH值变化规律与典型的钒酸钙/钒酸的锰酸溶率-pH值规律接近[8, 22]。HUANG等[8]在研究钒酸钙的酸溶行为时发现,Ca2V2O7中钒的酸溶率随pH值升高呈现出剧烈降低的趋势;WEN等[22]在研究钒酸锰熟料的酸溶过程时发现,当酸溶pH值由1.2逐渐升至2.4,钒的浸出率急剧降低。结合2.1节的表征结果及2.2节的热力学分析结果,进一步说明尾渣酸浸过程中主要发生了钒酸盐的溶解。
综合考虑钒浸出率、酸耗及后续酸浸液除杂,将酸浸pH值优化为0.5,此时钒的浸出率可达64.75%,浸出残渣的V2O5含量为1.04%。
2.4 酸浸温度对钒浸出率的影响
酸浸温度对尾渣中钒浸出率的影响如图6所示。其中,浸出pH值为0.5、液固比为1.5∶1、浸出时间为30 min。
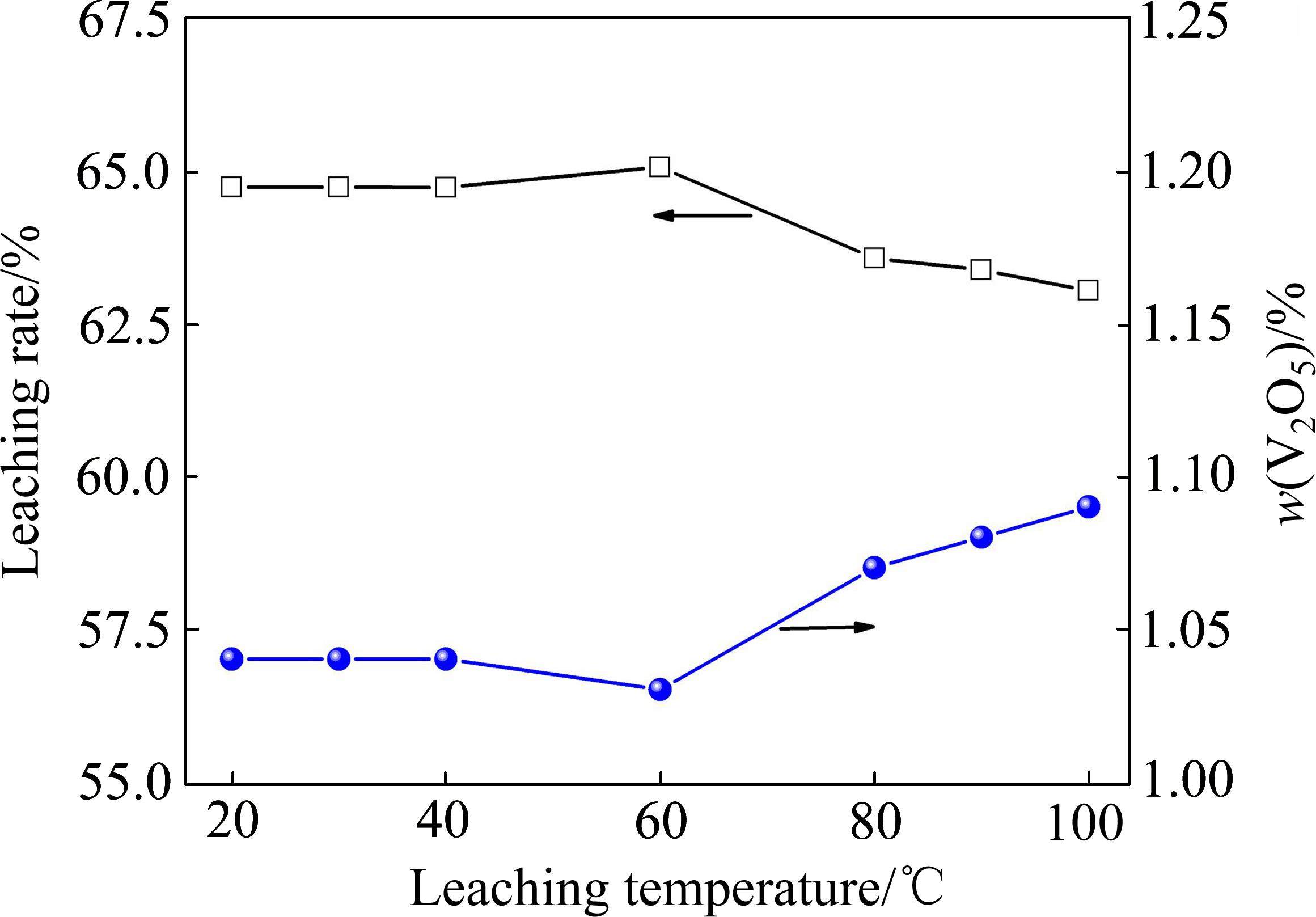
由图6可知,随着酸浸温度逐渐由20 ℃升高至100 ℃,尾渣中钒的浸出率呈现出分段变化的趋势,其中,在20~60 ℃,钒的浸出率随温度升高基本维持不变,当温度由60 ℃升高至100 ℃时,钒的浸出率随温度升高呈降低趋势,由65.08%降至63.05%,渣中钒含量则由1.03%增至1.09%。如前所述,尾渣酸溶过程中,钒酸盐优先被溶解,根据文献报道,Ca2V2O7、Mn2V2O7的酸溶性能良好,在H2SO4浓度较高时(如pH=0.5),酸溶反应速度较快,在一定温度范围内(室温以上)主要受扩散控制,因此升高温度对反应速率的影响不明显[8, 10, 21];当温度由60 ℃升高至100 ℃时,部分钒酸根发生水解生成V2O5·xH2O沉淀,从而导致钒的浸出率下降[8]。因此,优化的浸出温度确定为室温(25 ℃左右)。
2.5 酸浸液固比对钒浸出率的影响
在室温、浸出pH值为0.5、浸出时间30 min的条件下,考察了浸出液固比对尾渣中钒浸出率的影响,结果如图7所示。
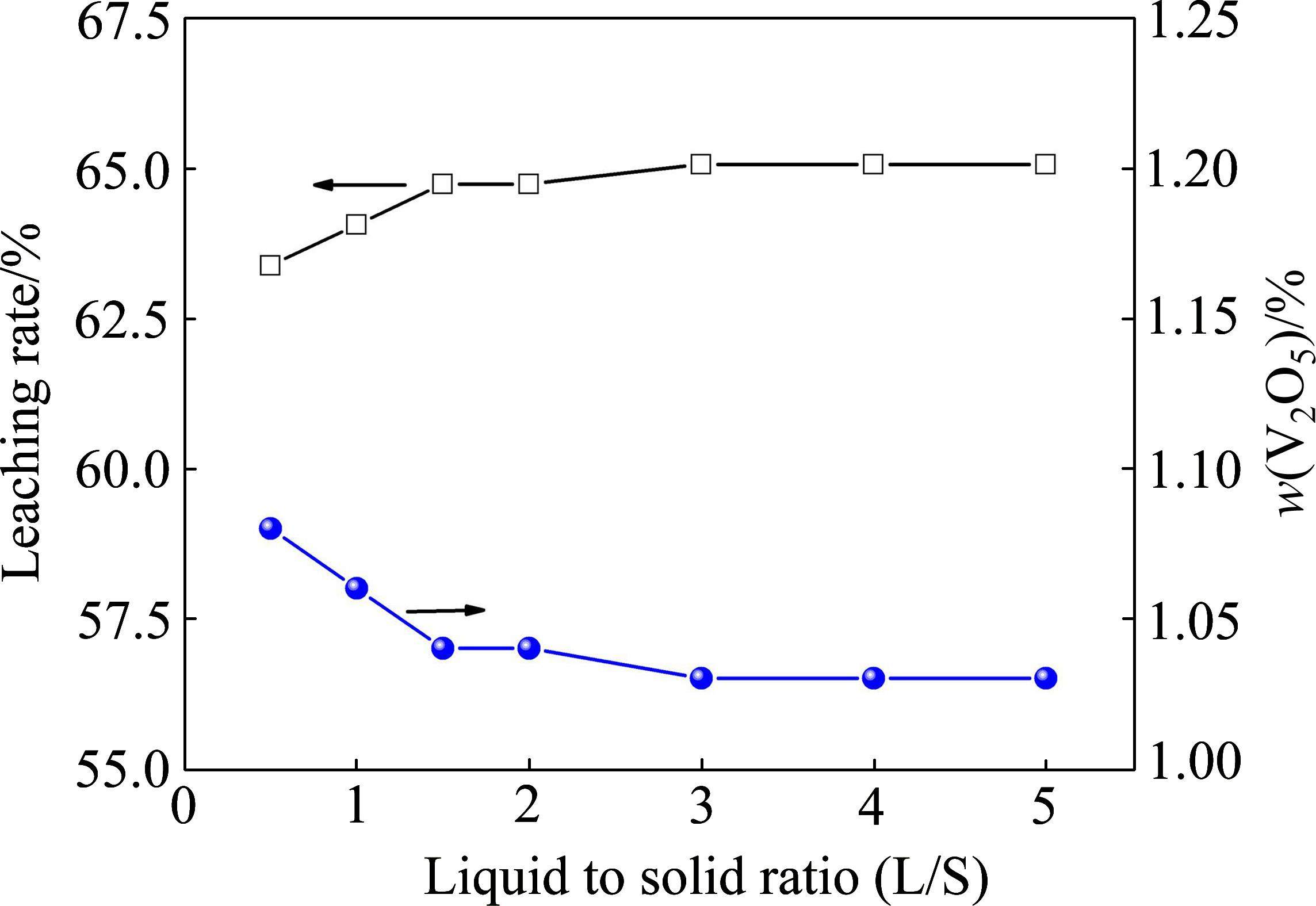
由图7可知,随浸出液固比逐渐升高,钒的浸出率总体呈现出增加趋势,当液固比由0.5升至1.5时,钒的浸出率由63.39%升至64.75%,此后进一步升高液固比,钒的浸出率仅呈现出轻微增加。如前所述,在pH值0.5、25 ℃条件下,Ca2V2O7及Mn2V2O7的酸溶反应主要受扩散控制[8, 10, 21],浸出液固比主要影响固液反应的外扩散过程,液固比越大,越有利于消除固体颗粒酸溶过程的外扩散阻力,起到动力学强化作用[21]。因此,上述结果表明,当液固比由0.5升至1.5,外扩散阻力逐渐弱化,而当液固比超过1.5后,外扩散对酸溶反应的影响基本被消除,因而增加液固比对钒浸出率的影响不明显。为尽可能消除外扩散阻力,同时减少浸出浆料处理量及提高浸出液中钒浓度,优选浸出液固比为1.5。
2.6 酸浸时间对钒浸出率的影响
最后,考察了酸浸时间对尾渣中钒浸出率的影响规律,其中,浸出温度为室温、酸浸pH值为0.5、液固比为1.5∶1,结果如图8所示。
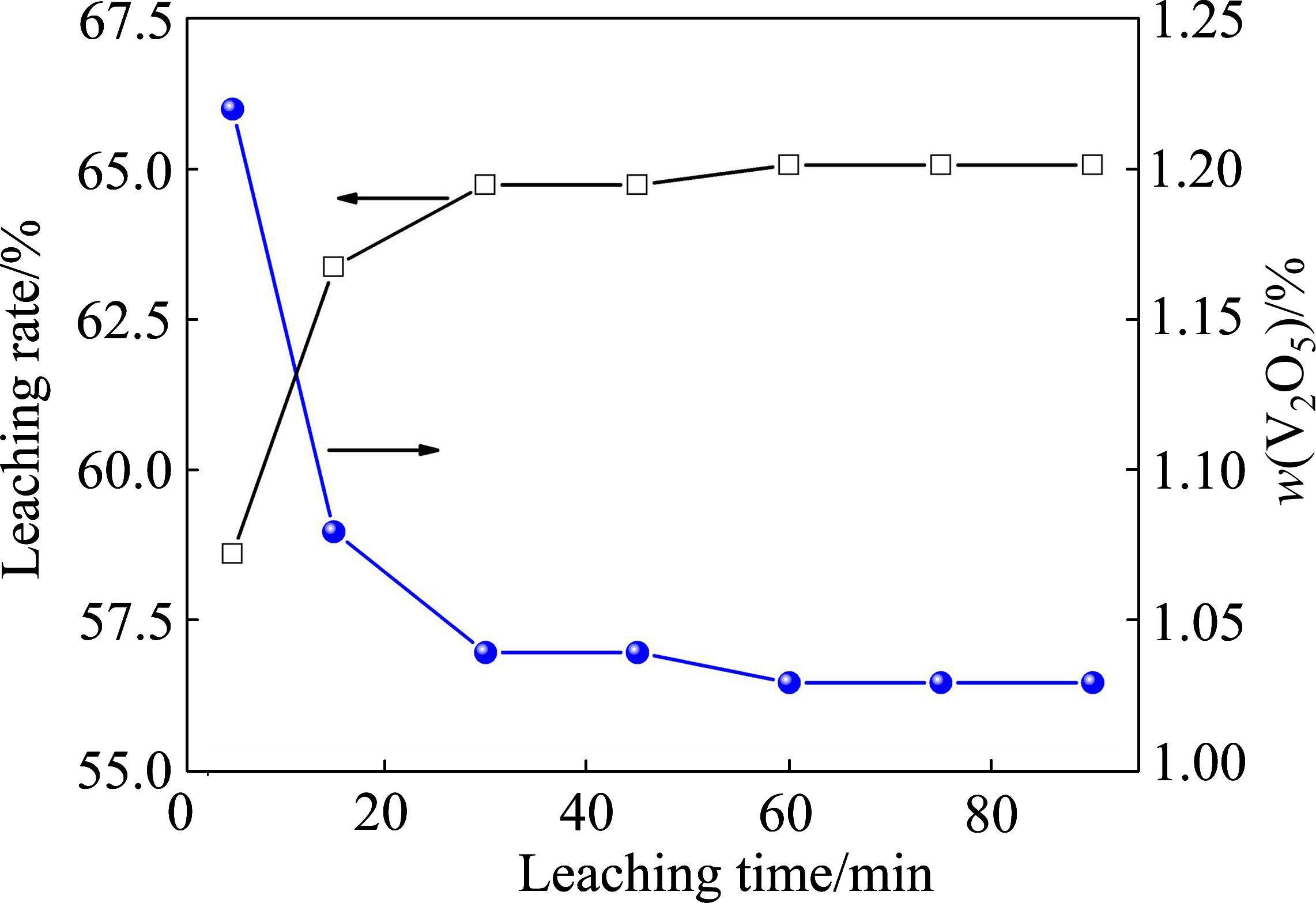
由图8可知,随着浸出时间逐渐延长,尾渣中钒的浸出率呈现出先增加后维持稳定的趋势,尾渣中钒含量则呈现出先降低后趋于平衡的趋势。当浸出时间逐渐延长至30 min时,钒的浸出率随时间延长快速增加,由5 min时的58.64%增至30 min时的64.75%,其后,进一步延长时间,钒的浸出率呈现出微弱增加的趋势。
Ca2V2O7及Mn2V2O7在pH值为0.5(H2SO4浓度较高)、室温(反应受扩散控制)、液固比1.5∶1(外扩散阻力较小)的条件下,与H2SO4的反应动力学较快[8, 10]。因此在浸出初期(5~30 min),Ca2V2O7及Mn2V2O7中的钒被快速溶出,浸出率随时间延长明显增大;然而,Ca2V2O7酸溶过程会生成硫酸钙 (CaSO4),且随着反应的进行,固相CaSO4包裹在未反应的Ca2V2O7外层,形成“核-壳”结构,传质阻力增加,反应受内扩散影响,导致反应后期(30~90 min)反应动力学变慢[8, 21]。此外,由2.2节可知,在低温时,尾渣中Fe2O3及Fe2TiO5也可能发生反应,在反应后期(30~90 min),当大部分Ca2V2O7及Mn2V2O7被溶解后,也可能溶解少量Fe2TiO5及Fe2O3并将其中的钒溶出。根据文献[23-25]报道,Fe2TiO5及Fe2O3结构致密,酸溶动力学较慢,该因素也可能导致反应后期钒的提取率随时间增加基本维持稳定。因此,通过尾渣直接酸浸,主要是将Ca2V2O7及Mn2V2O7等钒酸盐中的钒高效选择性提取,而在Fe2TiO5及Fe2O3中的钒,则难以被浸出。
综上所述,优化的浸出工艺调控条件如下:pH值为0.5、液固比为1.5∶1、室温浸出时间为 30 min。
2.7 酸浸尾渣及浸出液的表征与分析
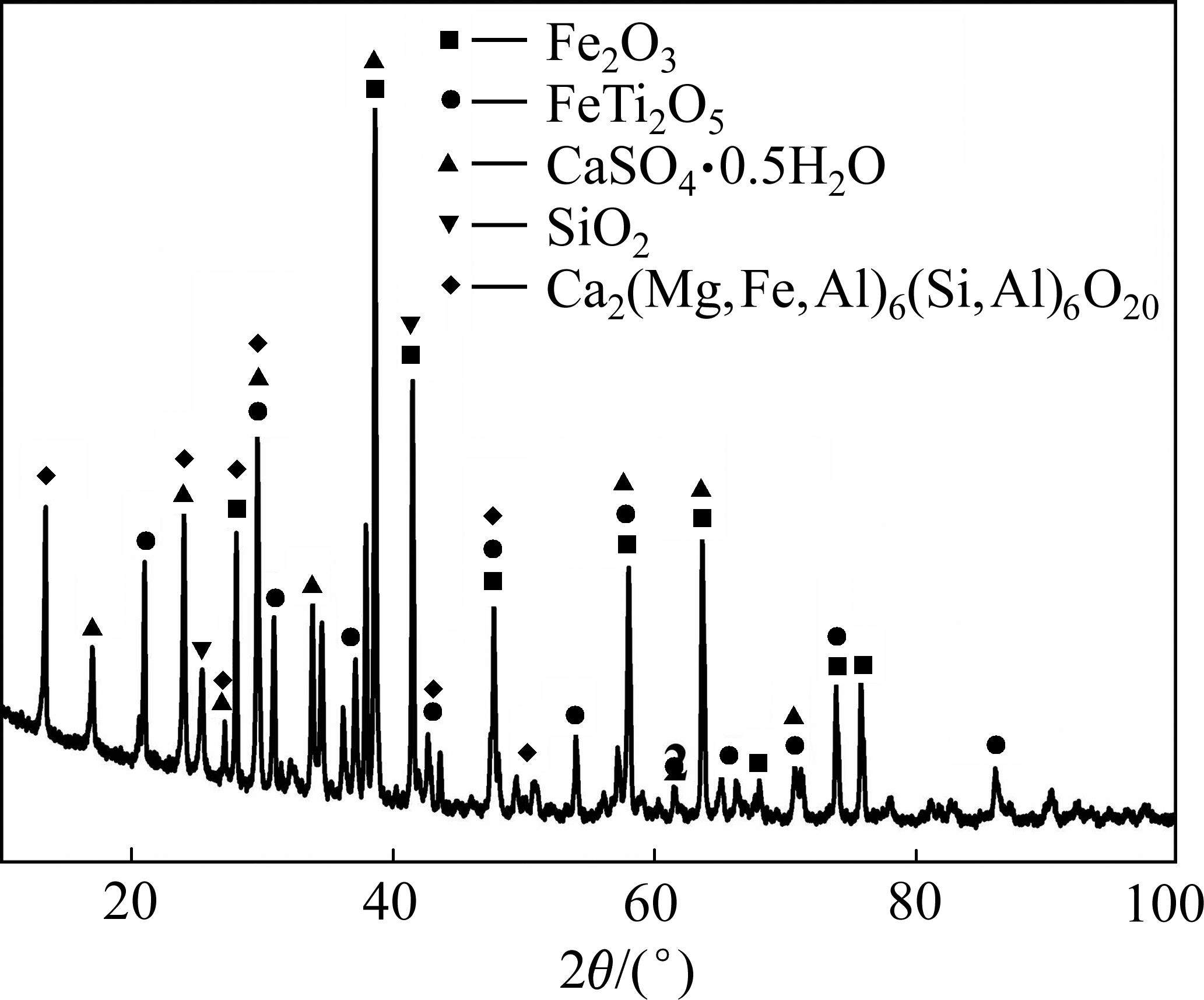
通过上述浸出试验,获得的最优浸出条件是pH值为0.5、液固比1.5∶1、室温浸出30 min,对上述条件下得到的酸浸尾渣进行XRD和SEM表征,结果分别如图9~10及表3所示。

Point No. | Mass fraction/% | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| V | Fe | Ti | Mn | Ca | Mg | Al | Si | O | |
| 1 | 3.52 | 37.84 | 18.11 | 5.28 | - | 2.89 | 2.88 | 1.44 | 23.74 |
| 2 | - | 6.54 | 1.33 | 7.08 | 13.78 | 9.99 | 3.13 | 26.92 | 31.22 |
| 3 | - | 15.61 | 2.78 | 5.94 | 6.94 | 2.26 | 4.56 | 28.96 | 31.52 |
| 4 | 1.46 | 55.66 | 4.69 | 2.82 | - | 2.54 | 2.37 | - | 22.76 |
XRD分析结果表明,酸浸尾渣主要由Fe2O3、Fe2TiO5、CaSO4·0.5H2O、SiO2和Ca2(Mg,Fe,Al)6-(Si,Al)6O28等物相组成,与酸浸前相比,未检测到新的物相。进一步通过SEM分析发现,酸浸尾渣中主要含Fe2O3、Fe2TiO5及硅酸盐相,未观察到钒酸盐物相,且铁板钛矿中的钒含量较酸溶前略微降低(见图3和表2),表明提钒尾渣中Ca2V2O7及Mn2V2O7中的钒基本被完全溶出,同时溶出少量其它物相(如:Fe2TiO5)中的钒。因此,提钒尾渣酸溶过程主要将Ca2V2O7及Mn2V2O7中的钒高效选择性溶出(钒的提取率64.75%),酸溶尾渣中的钒主要分布在Fe2O3、Fe2TiO5中。
为了进一步考察酸浸过程的选择性以及浸出液中钒回收的可行性,在上述优化的提钒尾渣酸浸条件下,进行循环浸出,浸出液成分如表4所示。其中,一次浸出获得的浸出液钒浓度为3.35 g/L,铁、磷、硅杂质含量分别为0.89、0.15、0.18 g/L,说明在尾渣酸浸过程中,能够实现钒的高效选择性提取,该方法具有效率高、成本低的优势。为了进一步提高钒浓度(便于后续钒产品制备),通过循环浸出,可获得钒浓度为6.46 g/L的浸出液,循环浸出使得浸出液中的铁、磷、硅等杂质出现不同程度富集,因此需要对浸出液进行除杂方能制备出合格的产品。
| Element | Content/(g∙L-1) | |
|---|---|---|
| One time leaching | Recycle leaching | |
| V | 3.35 | 6.56 |
| Si | 0.18 | 0.25 |
| Mn | 0.12 | 0.21 |
| P | 0.15 | 0.27 |
| Fe | 0.89 | 1.66 |
| Ca | 0.35 | 0.52 |
| Mg | 0.14 | 0.26 |
2.8 提钒尾渣酸浸液的纯化及钒的回收
如前所述,通过循环浸出可提升浸出液钒浓度,但铁、磷杂质浓度也被富集,不利于制备出合格的氧化钒产品。根据浸出液中铁、磷杂质特性,选用NH4HCO3调节溶液pH值,使铁、磷形成沉淀实现分离(见式(2)、式(3)),同时为后续沉钒提供NH4+,在室温下考察了除杂终点pH值对除杂效果的影响,结果如图11所示。


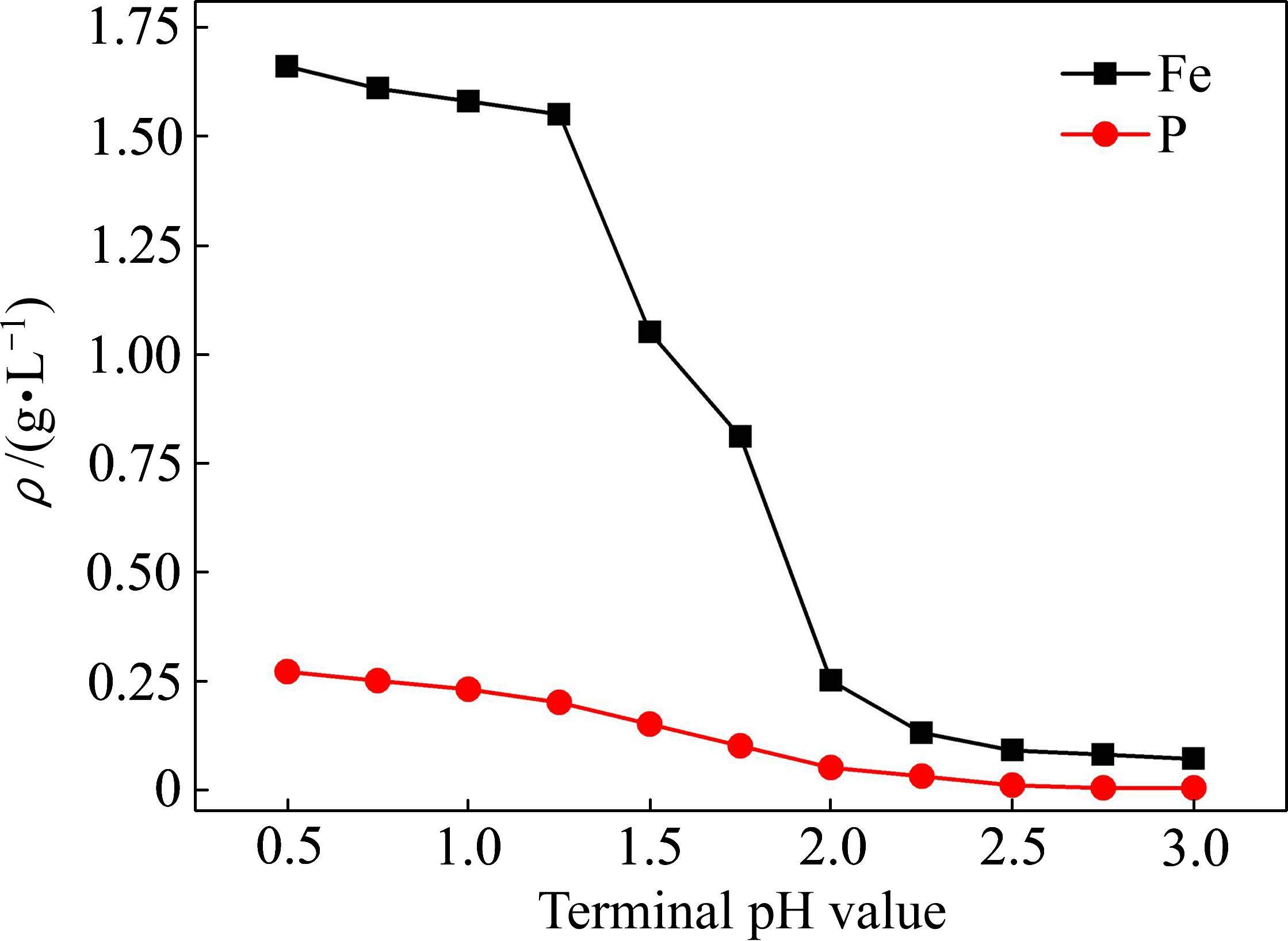
由图11可知,随着除杂终点pH值升高,浸出液中铁、磷浓度均呈现下降趋势,除杂反应的终点pH值为0.5~1.5时杂质去除率较低,pH值为1.5时铁、磷浓度分别为1.25、0.15 g/L,仍然无法满足沉钒要求。当pH值为2.5时,浸出液中铁浓度为0.10 g/L,磷浓度为0.01 g/L,钒浓度为6 g/L,可满足沉钒制备钒产品要求。随后向净化液(pH值为2.5)加酸,将pH调节至约2.0,100 ℃下加热90 min,过滤、洗涤获得多钒酸铵(APV)产品,于100 ℃干燥3 h,再经520 ℃煅烧120 min,获得V2O5产品(分别见式(4)和(5)),其主要化学成分如表5所示。由表5可知,V2O5产品达到了YB/T 5304—2017标准99级粉钒质量要求[26]。
| Composition | Mass fraction/% | |
|---|---|---|
| Standard | Sample | |
| V2O5 | ≥99.0 | 99.11 |
| Si | ≤0.08 | 0.05 |
| Fe | ≤0.08 | 0.06 |
| P | ≤0.03 | 0.01 |
| S | ≤0.08 | 0.06 |
| As | ≤0.01 | 0.003 |
| Na方正汇总行2O+K2O | ≤0.80 | 0.08 |
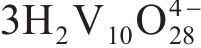

3 结论
1) 钒渣钙化提钒尾渣主要由Fe2O3、Fe2TiO5、CaSO4·0.5H2O等物相组成,尾渣中残留的钒主要存在于钒酸盐(Ca2V2O7、Mn2V2O7)、Fe2O3及Fe2TiO5物相中。
2) 通过直接酸浸,热力学上能够实现钒渣钙化提钒尾渣中钒酸盐 (Ca2V2O7、Mn2V2O7)中钒的选择性提取,尾渣中主要含钒物相酸溶反应的热力学优先顺序为:Ca2V2O7>Mn2V2O7>Fe2O3>Fe2TiO5。
3) 钒渣钙化提钒尾渣在pH值为0.5、液固比1.5、室温下浸出30 min,钒浸出率可达64.75%,可将尾渣中V2O5含量从2.95%降低至1.04%,浸出液中含少量铁、磷、硅杂质,实现了尾渣中钒的高效选择性提取。
4) 钒渣钙化提钒尾渣经过循环酸浸可将浸出液钒浓度提升至6.5 g/L,采用NH4HCO3调节浸出液pH值至2.5,浸出液中铁、磷浓度分别降低至0.1 g/L、0.01 g/L,实现了关键杂质的高效脱除,纯化后的钒溶液经过沉钒、煅烧,制备出纯度99%以上的V2O5产品,实现了钒的短流程、低成本利用。
李明, 杜光超, 叶露, 等. 提钒尾渣酸浸深度提钒及回收[J]. 中国有色金属学报, 2025, 35(1): 282-292. DOI: 10.11817/j.ysxb.1004.0609.2019-45120
LI Ming, DU Guangchao, YE Lu, et al. Further extraction and recovery of vanadium from vanadium residue by acid leaching[J]. The Chinese Journal of Nonferrous Metals, 2025, 35(1): 282-292. DOI: 10.11817/j.ysxb.1004.0609.2019-45120

