手术是重大的应激事件,受围手术期焦虑、住院环境及疾病影响,青少年手术患者普遍存在围手术期睡眠剥夺(sleep deprivation,SD)情况[1]。流行病学资料[2]显示青少年术后慢性疼痛发生率为20%~54%,中重度疼痛比例为11%~22%。越来越多的研究[3-4]证实青少年SD与慢性疼痛存在强相关性。Kansagra[5]研究发现SD高发于青少年群体。中国城市青少年SD患病率在15%~70%,而农村青少年SD患病率可高达78.8%[6]。此外,青少年慢性疼痛患者合并睡眠障碍的发生率为50%[7],且两种疾病共病易发生在青春期早期[8]。慢性疼痛与SD互为因果,这种双向调控关系对术后疼痛管理具有重要的影响。目前,有关SD调控术后疼痛的神经生物学证据有:阿片系统、单胺能系统(5-羟色胺、肾上腺素、多巴胺)、内源性大麻素系统、食欲素能系统、免疫系统和松果腺褪黑激素系统,以及下视脑-垂体-肾上腺素轴、腺苷和一氧化氮信号通路[9]。
5-羟色胺广泛分布于周围神经系统和中枢神经系统,其中5-羟色胺1A(5-hydroxytryptamine 1A,5-HT1A)受体(5-HT1A receptor,5-HT1AR)是表达最丰富、分布最广泛的5-HT1AR亚型,参与调节疼痛、睡眠、情绪等生理病理过程[10-11]。研究[12]发现在大鼠急性SD模型中,基底前脑中细胞外血清素和多巴胺代谢物水平显著增高,而多种形式的慢性睡眠限制则会导致5-HT1AR的敏感性显著降低[13]。在神经病理性疼痛和化学治疗痛模型中,激活脊髓5-HT1AR均可显著缓解小鼠慢性疼痛程度[14-15]。研究[16]提示脊髓5-HT1AR可以通过钙调蛋白激酶II(calmodulin-dependent protein kinase II,CaMKII)-细胞外调节蛋白激酶(extracellular signal-regulated kinases,ERK)-环磷腺苷效应元件结合蛋白(cAMP response element binding protein,CREB)信号通路参与调控炎症性疼痛。脊髓背角持续的CaMKⅡ信号激活可促进神经元兴奋性增高而导致痛觉过敏,是介导慢性疼痛的重要分子机制[17]。脊髓水平的突触神经元的兴奋性/抑制性(excitatory/inhibitory,E/I)平衡是参与调控痛信号传递的关键,E/I失衡会介导大量Ca2+内流,增强初级与次级神经元之间的信号传递,从而加剧疼痛程度,并延长疼痛持续时间[18-19]。本研究通过构建青春期小鼠SD联合足趾切口术模型,观察脊髓5-HT1AR在术前SD所致术后慢性疼痛中的表达变化,探讨5-HT1AR调控SD小鼠脊髓E/I失衡的分子机制,旨在为探索青少年术后慢性疼痛潜在治疗靶点提供理论依据。
材料与方法
材料
3周龄C57BL/6J雄性小鼠[许可证号:SCXK (浙)2020-0001]购自浙江维通利华实验动物技术有限公司,并饲养于室温(22±2) ℃、湿度40%~60%的环境中,小鼠可以自由获取水和饲料。本研究所有动物实验操作遵循相关规范并获得南京大学医学院附属鼓楼医院实验动物福利伦理委员会批准(审批号:2020AE01012)。
8-羟基-2-(二丙胺基)四氢萘(8-hydroxy-dipropylamino-tetralin,8-OH-DPAT)购自美国Sigma公司;U0126购自中国MCE公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自上海碧云天生物技术有限公司;组织蛋白裂解液购自美国ThermoFisher公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司;蛋白质印迹(Western blotting,WB)一抗5-HT1AR、1型囊泡膜谷氨酸转运体(vesicular glutamate transporter 1,VGlut1)、谷氨酸脱羧酶67(glutamic acid decarboxylase 67,GAD67)、CaMKII、磷酸化CaMKII(phosphorylated CaMKII,p-CaMKII)、N-甲基-D-天冬氨酸受体1(N-methyl-D-aspartic acid receptor 1,NR1)和磷酸化NR1(phosphorylated NR1,p-NR1)购自美国Abcam公司;突触后密度蛋白95(postsynaptic density protein-95,PSD95)、ERK和磷酸化ERK(phosphorylated ERK,p-ERK)购自美国Cell Signaling Technology公司;囊泡γ-氨基丁酸转运蛋白(vesicular GABA transporter,VGAT)、桥尾蛋白(gephyrin)、CREB、磷酸化CREB(phosphorylated CREB,p-CREB)和β-actin购自中国Proteintech公司;羊抗小鼠、羊抗兔WB二抗购自上海碧云天生物技术有限公司;免疫荧光(immunofluorescence,IF)法兔二抗购自美国Invitrogen公司;IF抗淬灭剂购自美国Abcam公司。
方法
分组
实验小鼠按照随机数字表法分为4组,即对照组(C组)、SD组、后足趾切口手术组(I组)、SD复合后足趾切口手术组(SI组)。C组:正常饲养,不进行任何处理;SD组:在小鼠3~4周龄时,进行连续4.5 d的SD造模;SI组:在小鼠3~4周龄时,进行连续4.5 d的SD造模,而后在吸入麻醉状态下进行右后肢足底切口手术;I组:小鼠不进行SD造模与SI组在同一天吸入麻醉状态下进行右后肢足底切口手术。
给予8-OH-DPAT和U0126干预以及相应溶剂(Vehicle)的对照小鼠也按照随机数字表法分为给药组和溶剂对照组,即SI+8-OH-DPAT组和SI+Vehicle组,SI+U0126组和SI+Vehicle组。
SD及后足趾切口术模型
参照Bellesi等[20]研究方法,采用SD箱构建小鼠SD模型,即在转棒式SD箱中连续剥夺小鼠睡眠 4.5 d,期间小鼠可自由获取食物和水。右后足趾部切口模型的构建参照Cowie等[21]研究方法,手术所用器械均经高压高温蒸汽灭菌。小鼠经2%异氟烷吸入麻醉后,呈仰卧位固定,采用碘伏对右后足手术部位进行消毒,铺无菌手术巾;自足底近端0.5 cm处作为起始点,使用手术刀片向跖部行纵向切开,切口总长度0.5 cm;使用眼科镊抬高足底肌肉,保持起始点和附着点的完整,上下摩挲数十次;随后退出眼科镊,使用无菌纱布轻压止血后,使用5-0带针缝合线缝合切口,缝合结束后使用青霉素涂抹伤口以预防感染;待小鼠苏醒后,将其轻柔地放回饲养笼。
小鼠鞘内注射给药
参考Wei等[22]的研究方法,经连续4.5 d的SD造模结束后,在实施足趾切开术前30 min,给予小鼠单次鞘内给药8-OH-DPAT,给药剂量为0.1 mg/kg;参考Zhong等[23]的研究方法,U0126鞘内单次给药时间同上,连续鞘内给药时间为测痛行为学前30 min,给药剂量为0.2 mg/kg。鞘内注射具体操作为:左手抓持小鼠并用大拇指和食指固定两侧髂前上棘部位,使脊椎呈水平位;剪去进针部位周围皮肤的毛发,使用碘伏棉球消毒穿刺部位皮肤,使用10 μL微量注射器抽取适量8-OH-DPAT、U0126或等量生理盐水,注射器针头与注射部位皮肤呈90°缓慢进针,小鼠出现甩尾动作时提示穿刺成功;固定注射针,缓慢推注,推注完成后停留约30 s,而后退出注射针,采用碘伏消毒注射部位;注意观察小鼠的后肢活动能力,若正常则提示注射成功,而后将小鼠轻柔地放回饲养笼。
PWMT测定
本实验采用Von Frey纤毛测定机械缩足阈值(paw withdrawl mechanical threshold,PWMT)。PWMT检测时间固定,以避免时间节律的改变而影响测量结果。在进行PWMT实验前,首先应将待检测小鼠轻柔地放入独立透明的玻璃隔间内(每个玻璃隔间长10 cm,宽10 cm,高15 cm),使其适应环境至少30 min。实验装置放置于实验人员正前方,以便实验人员进行测量,并尽量保持实验环境安静,避免惊扰实验小鼠。待实验小鼠完全安静后,使用Von Frey纤毛刺激小鼠右后足趾部皮肤,同时避开切口部位,刺激强度从低到高依次为0.16、0.40、0.60、1.00、1.40、2.00 g,每个强度重复测量5次,2次测量间隔至少5 min。小鼠出现舔舐后足或抬起右后足动作为阳性反应,当出现超过3次阳性反应时,该纤毛强度记录为PWMT。
WB实验
麻醉小鼠,采取断颈法取材,随后分离新鲜脊髓L3~5腰膨大组织进行蛋白质提取;充分裂解后,采用BCA法对各组小鼠脊髓腰膨大组织蛋白质定量、煮沸变性;经10%凝胶电泳、转膜、5%脱脂牛奶封闭后,加一抗于4 ℃下孵育过夜,加辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗于室温孵育1 h,用Tanon自动成像系统进行显影,曝光后保存图像并通过Image J软件进行灰度值分析,分析时采用β-actin作为蛋白质内参对各目标分子进行标化定量。
IF
麻醉小鼠,打开其胸腔,采用生理盐水及4%多聚甲醛进行心脏灌注,将取出的脊髓组织浸泡在4%多聚甲醛中,并于第2天转移到30%蔗糖溶液中进行组织脱水,直至组织沉底;将脊髓组织修剪后,对腰膨大段行冰冻组织切片,每片组织厚度20 μm;采用10%山羊血清封闭1 h,一抗4 ℃孵育过夜、IF二抗室温避光孵育2 h,抗淬灭剂封片后,通过荧光显微镜观察并拍摄,采用Image J软件计算平均荧光强度。
统计学处理
采用SPSS 22.0统计学软件进行数据分析和处理,使用GraphPad Prism软件进行绘图,定量数据以均数±标准差表示,痛行为学PWMT结果采用重复测量方差分析。WB实验和IF定量结果采用单因素方差分析。P<0.05为差异有统计学意义。
结 果
青春期小鼠慢性SD会导致术后慢性疼痛
通过测量PWMT来评估连续4.5 d的SD造模对青春期小鼠术后疼痛行为的影响(图1A)。图1B显示:与C组比较,SD组第1~7天PWMT下降,差异有统计学意义(P<0.001),第10天恢复至基线水平;I组第1天PWMT降低,差异有统计学意义(P<0.001),第10天恢复至基线水平;SI组第1~7天PWMT下降,差异有统计学意义(P<0.001),第14天恢复至基线水平;此外,与I组比较,SI组第5~10天PWMT降低,差异有统计学意义(P<0.001)。

青春期SD小鼠脊髓中兴奋性和抑制性突触相关蛋白质表达变化
WB结果显示:在术后第7天,与C组比较,SI组兴奋性突触相关蛋白质PSD95、VGlut1和p-NR1表达水平上调,差异有统计学意义(P<0.05);与I组比较,SI组PSD95表达水平升高,差异有统计学意义(P<0.05),p-NR1和VGlut 1蛋白表达水平有升高趋势,但差异无统计学意义(P>0.05,图2A~C);与C组比较,SD组抑制性突触相关蛋白VGAT表达水平下调,差异有统计学意义(P<0.05);与I组比较,SI组抑制性突触相关蛋白gephyrin、GAD67和VGAT水平均下调,差异均有统计学意义(均P<0.05,图2D和2E)。
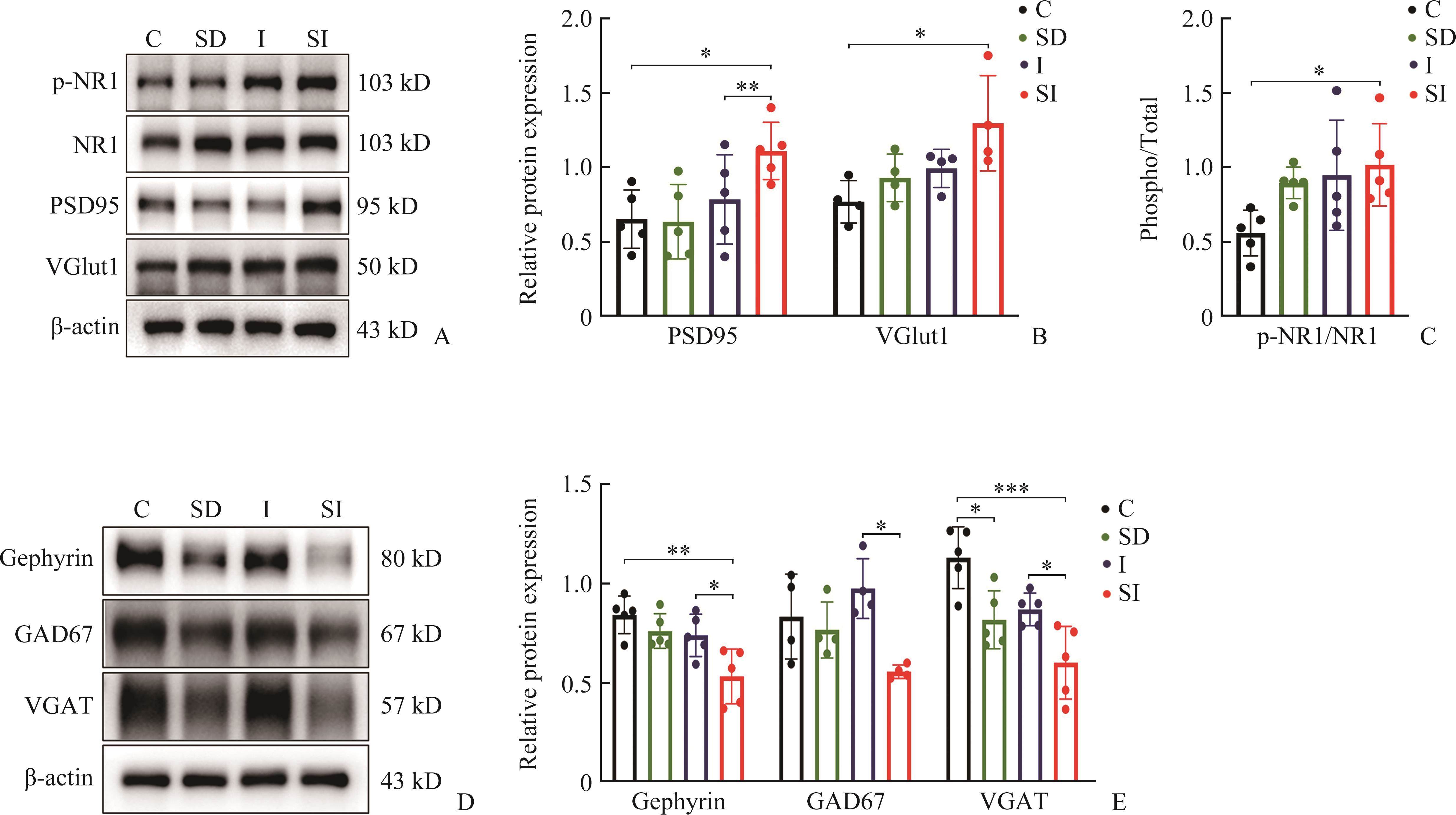
SD下调青春期小鼠脊髓中5-HT1AR表达水平
WB检测小鼠脊髓组织中5-HT1AR蛋白表达水平,结果显示:与第0天相比,SI组5-HT1AR蛋白水平在术后第7天下调(P<0.05,图3A和3B);术后第7天,SI组5-HT1AR蛋白水平低于I组和C组(P<0.05或P<0.01,图3C和3D)。免疫荧光结果显示:与I组比较,SI组小鼠脊髓背角5-HT1AR阳性表达在术后第7天下降(P<0.01,图3E和3F)。

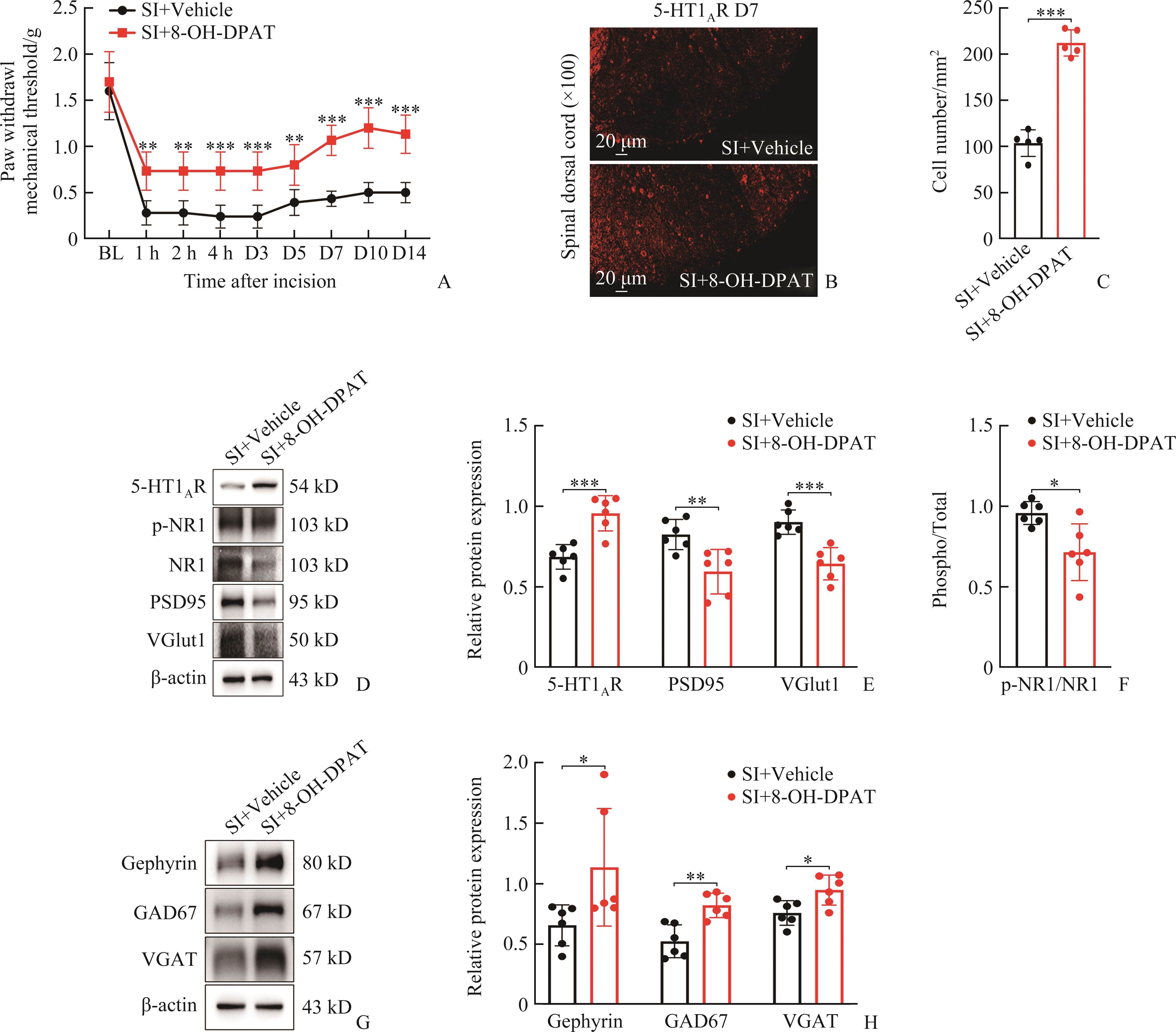
鞘内单次注射8-OH-DPAT可通过调节E/I平衡减轻术后慢性疼痛
向小鼠鞘内注射5-HT1AR选择性激动剂8-OH-DPAT(0.5 µg/µL),结果显示:SI+8-OH-DPAT组各时点PWMT值均高于SI+Vehicle组(均P<0.01,图4A);术后第7天,SI+8-OH-DPAT组小鼠脊髓5-HT1AR的阳性表达水平高于SI+Vehicle组(P<0.001,图4B和4C)。WB检测E/I平衡相关蛋白,结果显示SI+8-OH-DPAT组p-NR1、PSD95和VGlut1水平均低于SI+Vehicle组(均P<0.05,图4D和4F);同时,SI+8-OH-DPAT组gephyrin、GAD67和VGAT表达水平均升高(均P<0.05,图4G和4H)。
5-HT1AR通过CaMKII-ERK-CREB信号通路缓解青春期小鼠SD诱导的慢性术后疼痛
通过检测小鼠脊髓组织CaMKII-ERK-CREB信号通路关键蛋白质的表达水平发现:与C组比较,SI组 p-CaMKII、p-ERK和p-CREB水平在术后第7天均升高,差异有统计学意义(P<0.05和P<0.01,图5A和5B);与SI+Vehicle组比较,SI+8-OH-DPAT组术后第7天p-CaMKII、p-ERK和p-CREB水平均下调,差异均有统计学意义(均P<0.05,图5C和5D)。
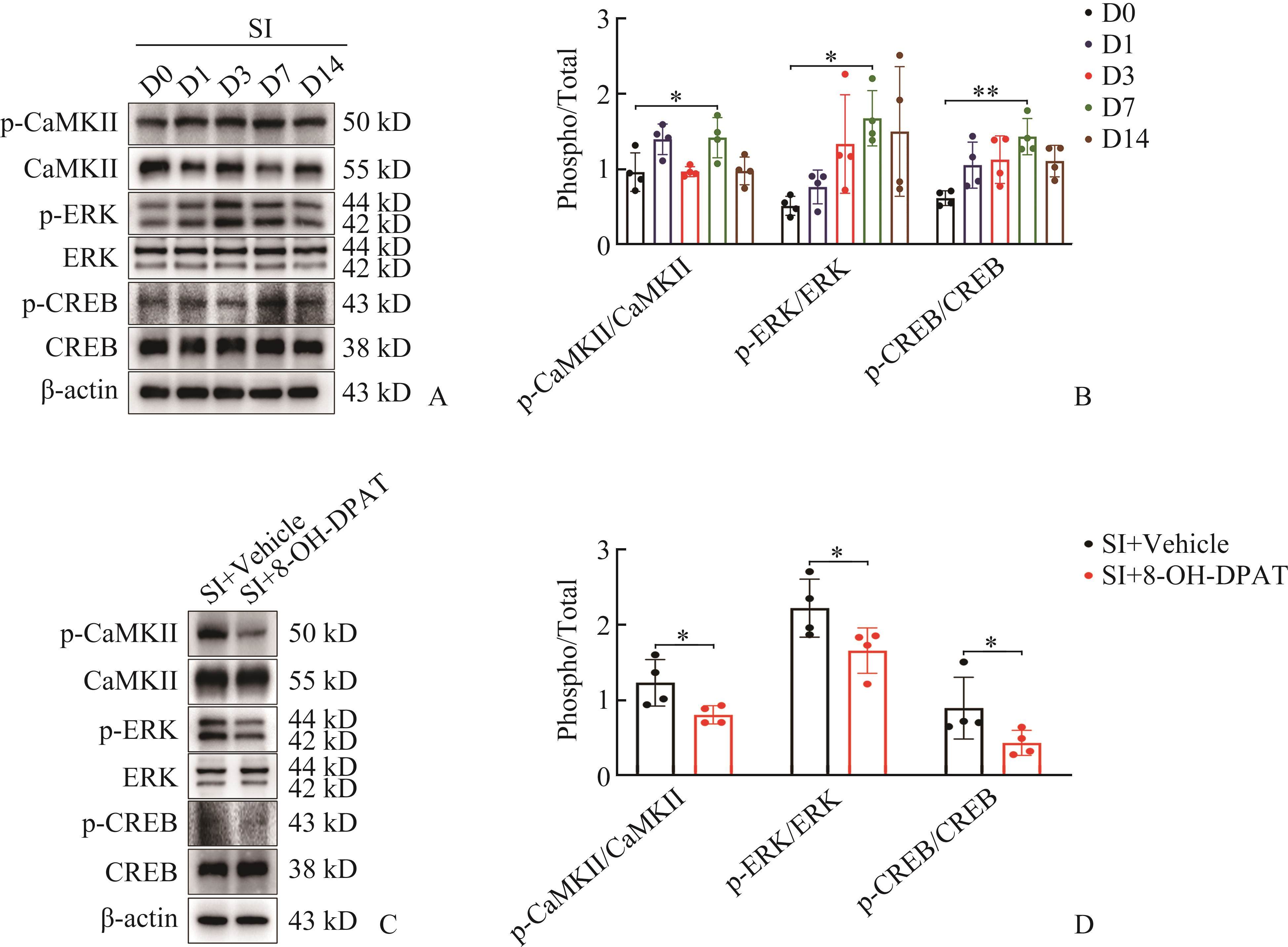
为进一步验证CaMKII-ERK-CREB信号通路参与疼痛调节,将ERK拮抗剂U0126(0.5 µg/µL)注入小鼠鞘内,痛行为学检测发现单次注射U0126可增加术后1~6 h的PWMT值,差异均有统计学意义(均P<0.001,图6A);此外,术后持续注射U0126达7 d后,第1~7天的PWMT值与SI+Vehicle组相比均升高,差异有统计学意义(P<0.001,图6B),提示U0126对缓解机械性痛敏具有长期疗效。与SI+Vehicle组比较,SI+U0126组p-CaMKII、p-ERK和p-CREB表达水平均下调,差异有统计学意义(P<0.05和P<0.01,图6C和6D)。

讨 论
研究[24]表明青少年患者发生术后慢性疼痛的主要危险因素有术前疼痛强度高、焦虑和睡眠障碍。本研究构建SD联合足跖切口术青春期小鼠模型,发现青春期小鼠连续4.5 d的SD造模加重了术后急性疼痛的程度,延长了术后疼痛的缓解时间。脊髓背角是伤害性感受信息传递和整合的重要场所,E/I失衡是疼痛慢性化的病理基础[25]。青春期是生长发育的关键时期,睡眠结构以及神经发育(包括突触形成、突触修剪和神经递质受体敏感性)均会发生显著变化[26-27]。与更早期发育或成年期相比,青春期神经炎症反应对感觉、认知和情绪等影响更为深远[28]。本研究发现青春期小鼠在SD诱导急性疼痛慢性化过程中,脊髓水平兴奋性突触相关蛋白(PSD95、pNR1/NR1)水平升高,抑制性突触相关蛋白质(gephyrin、GAD67和VGAT)表达下降。
脊髓背角5-HT1AR属于突触后异受体,接受来自中缝背核提供的血清素能神经元投射[29]。脊髓水平的5-HT1AR激活后可加剧疼痛,而脊髓水平突触后5-HT1AR激活则发挥抗伤害性感受的作用[14]。5-HT1AR激动剂在青春期和成年期均发挥了镇痛和抗焦虑的作用[30]。此外,在青春期长期服用5-HT1AR 激动剂丁螺环酮,可以逆转关键青春期不良结局引起的新生儿炎性疼痛和心理情绪行为的长期负性影响[31]。5-羟色胺耗竭会加重酒精暴露下青春期小鼠的疼痛敏感性和持续的抑郁样行为[32]。研究[16]报道炎性痛大鼠脊髓中p-NR1水平升高,而应用5-HT1AR激动剂处理则可以显著缓解炎性痛并降低大鼠脊髓p-NR1的表达。本研究发现鞘内注射5-HT1AR激动剂可以通过下调脊髓兴奋性突触蛋白表达和上调抑制性突触蛋白表达来纠正SD诱导的E/I失衡,进而缓解青春期SD所致术后慢性疼痛。
研究[33-34]表明N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)-CaMKII-ERK-CREB信号途径在外周和脊髓中枢敏化中具有重要作用。脊髓背角ERK异常激活在维持持续性炎症性疼痛超敏反应中发挥了关键作用[35]。ERK抑制剂U0126被广泛用于研究ERK信号通路在急性和慢性疼痛中的作用:U0126皮下给药可以显著减轻奥沙利铂诱导的痛觉过敏[36];鞘内注射U0126抑制ERK激活可以减轻糖尿病相关的瘙痒和痛觉减退[37],抑制弗氏完全佐剂或甲醛诱导的疼痛超敏反应[38-39];U0126鞘内给药还能显著抑制脊髓CREB信号激活,从而缓解神经病理性疼痛程度[40]。一项II期临床试验[41]发现ERK抑制剂PD-0325901能有效改善青少年和成人神经纤维瘤患者的慢性疼痛状况。本研究中,单次及连续鞘内注射ERK抑制剂U0126可通过抑制CaMKII-ERK-CREB通路显著减轻青春期小鼠SD所致术后急性和慢性疼痛程度。
综上所述,本研究发现鞘内注射选择性5-HT1AR激动剂8-OH-DPAT可有效缓解SD诱导的慢性术后疼痛;单次或连续鞘内注射ERK抑制剂U0126可缓解SD诱导的急性和慢性疼痛;经8-OH-DPAT、U0126处理的小鼠脊髓背角CaMKII、ERK和CREB的磷酸化水平显著下调。上述结果提示5-HT1AR激动剂通过抑制CaMKII-ERK-CREB信号通路来纠正脊髓背角E/I失衡,进而缓解青春期SD所致慢性术后疼痛。
Pediatric perioperative measures of sleep, pain, anxiety and anesthesia emergence: a healing touch proof of concept randomized clinical trial
[J]. Complement Ther Med, 2019, 42: 264-269. https://doi.org/10.1016/j.ctim.2018.11.027.Prevalence and predictors of chronic postsurgical pain in children: a systematic review and meta-analysis
[J]. J Pain, 2017, 18(6): 605-614. https://doi.org/10.1016/j.jpain.2017.03.007.Sleep health assessment and treatment in children and adolescents with chronic pain: state of the art and future directions
[J]. J Clin Med, 2022, 11(6): 1491. https://doi.org/10.3390/jcm11061491.The complexities of the sleep-pain relationship in adolescents: a critical review
[J]. Sleep Med Rev, 2023, 67: 101715. https://doi.org/10.1016/j.smrv.2022.101715.Sleep disorders in adolescents
[J]. Pediatrics, 2020, 145(Factors associated with sleep disorders among adolescent students in rural areas of China
[J]. Front Public Health, 2023, 11: 1152151. https://doi.org/10. 3389/fpubh.2023.1152151.Baseline sleep disturbances modify outcome trajectories in adolescents with chronic pain receiving Internet-delivered psychological treatment
[J]. J Pain, 2022, 23(7): 1245-1255. https://doi.org/10. 1016/j.jpain.2022.03.003.Sleep phase and pre-sleep arousal predicted co-developmental trajectories of pain and insomnia within adolescence
[J]. Sci Rep, 2022, 12(1): 4480. https://doi.org/10.1038/s41598-022-08207-y.Sleep deficiency and chronic pain: potential underlying mechanisms and clinical implications
[J]. Neuropsychopharmacology, 2020, 45(1): 205-216. https://doi.org/10.1038/s41386-019-0439-z.Serotonin in pain and analgesia: actions in the periphery
[J]. Mol Neurobiol, 2004, 30(2): 117-125. https://doi.org/10.1385/MN:30:2:117.Targeting Serotonin 1A receptors for treating chronic pain and depression
[J]. Curr Neuropharmacol, 2019, 17(12): 1098-1108. https://doi.org/10.2174/1570159X17666190811161807.Increases in extracellular serotonin and dopamine metabolite levels in the basal forebrain during sleep deprivation
[J]. Brain Res, 2011, 1399: 40-48. https://doi.org/10.1016/j.brainres.2011.05.008.Restricted and disrupted sleep: effects on autonomic function, neuroendocrine stress systems and stress responsivity
[J]. Sleep Med Rev, 2008, 12(3): 197-210. https://doi.org/10.1016/j.smrv.2007.07.007.Role of 5-HT receptors in neuropathic pain: potential therapeutic implications
[J]. Pharmacol Res, 2020, 159: 104949. https://doi.org/10.1016/j.phrs.2020.104949.Electroacupuncture alleviates chemotherapy-induced pain through inhibiting phosphorylation of spinal CaMKII in rats
[J]. Eur J Pain, 2018, 22(4): 679-690. https://doi.org/10.1002/ejp.1132.Spinal serotonin 1A receptor contributes to the analgesia of acupoint catgut embedding by inhibiting phosphorylation of the N-methyl-d-aspartate receptor GluN1 subunit in complete Freund’s adjuvant-induced inflammatory pain in rats
[J/OL]. J Pain, 2019, 20(1): 16.e1-16[SIRT1 mediates the excitability of spinal CaMKIIα-positive neurons and participates in neuropathic pain by controlling Nav1.3
[J/OL]. CNS Neurosci Ther, 2024, 30(6): e14764[Menthol facilitates excitatory and inhibitory synaptic transmission in rat medullary dorsal horn neurons
[J]. Brain Res, 2021, 1750: 147149. https://doi.org/10.1016/j.brainres.2020.147149.Calcineurin and CK2 reciprocally regulate synaptic AMPA receptor phenotypes via α2δ-1 in spinal excitatory neurons
[J/OL]. J Neurosci, 2024, 44(29): e0392242024[Sleep loss promotes astrocytic phagocytosis and microglial activation in mouse cerebral cortex
[J]. J Neurosci, 2017, 37(21): 5263-5273. https://doi.org/10.1523/JNEUROSCI.3981-16.2017.A mouse model of postoperative pain
[J/OL]. Bio Protoc, 2019, 9(2): e3140[Role of spinal 5-HT receptors in cutaneous hypersensitivity induced by REM sleep deprivation
[J]. Pharmacol Res, 2008, 57(6): 469-475. https://doi.org/10. 1016/j.phrs.2008.05.007.Crosstalk between Cdk5/p35 and ERK1/2 signalling mediates spinal astrocyte activity via the PPARγ pathway in a rat model of chronic constriction injury
[J]. J Neurochem, 2019, 151(2): 166-184. https://doi.org/10. 1111/jnc.14827.Longitudinal resilience and risk factors in pediatric postoperative pain (LORRIS): protocol for a prospective longitudinal Swiss University children’s hospitals-based study
[J]. BMJ Open, 2024, 14(3): e080174[Identification of spinal circuits transmitting and gating mechanical pain
[J]. Cell, 2014, 159(6): 1417-1432. https://doi.org/10.1016/j.cell.2014.11.003.Changes in sleep as a function of adolescent development
[J]. Neuropsychol Rev, 2011, 21(1): 5-21. https://doi.org/10.1007/s11065-010-9155-5.Immunoadolescence: Neuroimmune development and adolescent behavior
[J]. Neurosci Biobehav Rev, 2016, 70: 288-299. https://doi.org/10. 1016/j.neubiorev.2016.05.035.Genetically expressed transneuronal tracer reveals direct and indirect serotonergic descending control circuits
[J]. J Comp Neurol, 2008, 507(6): 1990-2003. https://doi.org/10.1002/cne.21665.Serotonin-1A receptor dependent modulation of pain and reward for improving therapy of chronic pain
[J]. Pharmacol Res, 2018, 134: 212-219. https://doi.org/10.1016/j.phrs.2018.06.030.Long-term effects of chronic buspirone during adolescence reduce the adverse influences of neonatal inflammatory pain and stress on adaptive behavior in adult male rats
[J]. Front Behav Neurosci, 2017, 11: 11. https://doi.org/10.3389/fnbeh.2017.00011.Adolescent ethanol drinking promotes hyperalgesia, neuroinflammation and serotonergic deficits in mice that persist into adulthood
[J]. Brain Behav Immun, 2023, 107: 419-431. https://doi.org/10.1016/j.bbi.2022.07.160.Inhibition of microglial NLRP3 with MCC950 attenuates microglial morphology and NLRP3/caspase-1/IL-1β signaling in stress-induced mice
[J]. J Neuroimmune Pharmacol, 2022, 17(3/4): 503-514. https://doi.org/10.1007/s11481-021-10037-0.Wnt/Ryk signaling contributes to neuropathic pain by regulating sensory neuron excitability and spinal synaptic plasticity in rats
[J]. Pain, 2015, 156(12): 2572-2584. https://doi.org/10.1097/j.pain.0000000000000366.ERK MAP kinase activation in superficial spinal cord neurons induces prodynorphin and NK-1 upregulation and contributes to persistent inflammatory pain hypersensitivity
[J]. J Neurosci, 2002, 22(2): 478-485. https://doi.org/10.1523/JNEUROSCI.22-02-00478.2002.Neuroendocrine mechanisms in oxaliplatin-induced hyperalgesic priming
[J]. Pain, 2023, 164(6): 1375-1387. https://doi.org/10.1097/j.pain. 0000000000002828.The role of Nav1.7 and methylglyoxal-mediated activation of TRPA1 in itch and hypoalgesia in a murine model of type 1 diabetes
[J]. Theranostics, 2019, 9(15): 4287-4307. https://doi.org/10.7150/thno. 36077.ERK MAP kinase activation in spinal cord regulates phosphorylation of Cdk5 at serine 159 and contributes to peripheral inflammation induced pain/hypersensitivity
[J/OL]. PLoS One, 2014, 9(1): e87788[Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions
[J]. Nat Med, 2010, 16(5): 592-597, 597. https://doi.org/10. 1038/nm.2123.Isotalatizidine, a C19-diterpenoid alkaloid, attenuates chronic neuropathic pain through stimulating ERK/CREB signaling pathway-mediated microglial dynorphin A expression
[J]. J Neuroinflammation, 2020, 17(1): 13. https://doi.org/10.1186/s12974-019-1696-9.NF106: a neurofibromatosis clinical trials consortium phase II trial of the MEK inhibitor mirdametinib (PD-0325901) in adolescents and adults with NF1-related plexiform neurofibromas
[J]. J Clin Oncol, 2021, 39(7): 797-806. https://doi.org/10.1200/JCO.20. 02220.作者声称无任何利益冲突。
朱魏, 徐璇, 徐睿, 黄瑜琳, 马正良. 5-羟色胺1A受体激动剂缓解青春期小鼠术前睡眠剥夺所致术后慢性疼痛的作用机制[J]. 中南大学学报(医学版), 2024, 49(10): 1543-1555. DOI:10.11817/j.issn.1672-7347.2024.240499
ZHU Wei, XU Xuan, XU Rui, HUANG Yulin, MA Zhengliang. 5-HT1AR agonist alleviates presurgical prolonged sleep deprivation-induced postsurgical pain in adolescent mice[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1543-1555. DOI:10.11817/j.issn.1672-7347.2024.240499
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101543.pdf
http://dx.chinadoi.cn/

