外泌体是一种直径为40~160 nm的细胞外囊泡,可由多种细胞分泌,通过胞内的多泡体与细胞膜融合释放到细胞外而产生[1]。外泌体内部可装载生长因子、蛋白质、脂质、核酸[包括长链非编码RNA(long noncoding RNA,lncRNA)和环状RNA(circular RNA,circRNA)]等多种物质,并在血液、尿液、唾液和母乳等体液中循环[2]。巨噬细胞、肿瘤细胞、间充质干细胞、上皮细胞、肥大细胞、内皮祖细胞和成纤维细胞等不同类型的细胞均可释放出外泌体[3]。外泌体携带与源细胞相似的脂质和蛋白质,可通过胞外作用从细胞释放到细胞外微环境中,与受体细胞相互作用,触发分子释放或诱导信号转导级联反应,最终导致细胞活性或功能的改变[4]。这些特性使其能够被多种肿瘤细胞利用并进行病理转运,参与肿瘤微环境(tumor microenvironment,TME)的建立,促进肿瘤生长,通过与肿瘤基质相互作用,促进肿瘤增殖,逃避宿主免疫系统的探测和破坏[5-7]。因此外泌体也是肿瘤发生发展的重要影响因素。研究表明,外泌体可参与调节肿瘤的微环境,影响肿瘤的增殖和发展。基于在肿瘤发展中的广泛研究,外泌体已经成为寻找肿瘤新治疗方法的焦点[8]。外泌体可促进血管生成、抑制肿瘤细胞死亡、增强肿瘤细胞侵袭和转移能力[9-11]。外泌体还能增强肿瘤细胞对放疗和化学治疗的耐药性,从而降低肿瘤治疗效果[12]。
外泌体具有双重作用,除在肿瘤发生、血管生成和转移中发挥重要作用外,还可在抑制肿瘤进展方面发挥重要作用[13]。铁死亡(ferroptosis)作为一种新发现的细胞程序性死亡机制,主要特征为脂质代谢紊乱、谷胱甘肽(glutathione,GSH)失衡和铁代谢紊乱。铁死亡相关蛋白谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4),以谷胱甘肽为底物,抑制有毒过氧化物形成无毒羟基组分,保护细胞膜的稳定性,使其正常生理功能不受过氧化物的干扰和破坏,从而抑制肿瘤细胞的铁死亡[14]。GPX4基因缺失可导致脂质过氧化,进而调控肿瘤发展中的铁死亡通路[15]。铁死亡的另一种特征是铁的积累,铁在生理过程中是必不可少的,但过量的铁会对身体有害。增强细胞铁输出已被证明可以增加细胞对铁死亡的抵抗力[16-17]。此外,活性氧(reactive oxygen species,ROS)的聚集也与铁死亡密切相关。脂质ROS在细胞内聚集,由于脂质过氧化过程的作用,可损伤细胞膜,最终导致细胞死亡。当GPX4和GSH被耗尽时,ROS的积累会产生细胞毒性,从而诱导细胞铁死亡[18]。酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)在调节脂肪酸和脂质代谢中起关键作用。外泌体介导的微小RNA(miRNA)可调节ACSL4的表达,从而在铁死亡中发挥作用[19]。已有研究[20-22]表明,激活铁死亡相关通路可以有效地阻止肿瘤进展,增强化学治疗、靶向治疗甚至免疫治疗的效果。近年来,外泌体参与调控肿瘤细胞铁死亡的机制研究引起了广泛关注,外泌体与铁死亡之间的关系亟需探索,以期为肿瘤治疗提供新的策略。
外泌体参与调控铁死亡介导肿瘤发展
外泌体可通过诱导肿瘤细胞铁死亡,介导细胞免疫反应,调节肿瘤微环境,进而发挥抗肿瘤作用。肿瘤源性外泌体(tumor cell-derived exosome,TEX)可将生物活性因子转运至外周血参与肿瘤的迁移,并可促进肿瘤细胞逃离免疫系统的监视[23]。一些富含miRNA的TEX被认为是有希望的肿瘤标志物[24]。Jiang等[25]从骨肉瘤组织中提取外泌体,并通过体内、外实验探讨外泌体中miR-144-3p和E盒结合锌指蛋白1(E-box-binding zinc finger protein 1,ZEB1)是否影响骨肉瘤细胞,研究结果证实miR-144-3p可通过负调控ZEB1的表达,诱导骨肉瘤细胞发生铁死亡,从而抑制骨肉瘤细胞的增殖、迁移和侵袭。
大量研究表明,在肿瘤中,外泌体不仅对铁死亡有诱导作用,还可抑制铁死亡的发生,进而发挥对肿瘤的作用。例如,在探讨miR-217在膀胱癌组织源性外泌体中的作用及其机制的研究[26]中发现,膀胱癌组织来源的外泌体通过转运miR-217抑制膀胱癌T24细胞的铁死亡。在胰腺癌细胞中,其分泌的外泌体中富集的天门冬氨酸转氨酶1(aspartate transaminase 1,GOT1)可抑制细胞铁死亡,促进肿瘤细胞增殖、侵袭和迁移。另有结果显示外泌体GOT1通过上调C-C趋化因子受体2(C-C chemokine receptor 2,CCR2)表达激活核因子E2相关因子2(nuclearfactor erythroidderived 2-like 2,Nrf2)/血红素氧合酶1(heme oxygenase-1,HO-1)信号通路,抑制胰腺癌细胞铁死亡,促进胰腺癌进展[27]。Yuan等[28]通过体外实验发现心肌外泌体可保护心肌梗死后的癌细胞免受铁死亡的影响。进一步研究表明,心肌梗死可通过释放源自心肌细胞中富集的miR -22-3p的外泌体,抑制肿瘤细胞中ACSL4的表达,进而抑制铁死亡,从而促进肿瘤的生长。
肿瘤微环境(tumor microenvironment,TME)由细胞外基质和多种间充质细胞类型组成,包括成纤维细胞、炎症细胞、壁细胞和内皮细胞[29]。肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)是肿瘤微环境中主要的基质细胞类型,可通过传递核酸、蛋白质等信号分子调控肿瘤发生和进展,在肿瘤生长、转移、免疫抑制和耐药中发挥重要作用[30-31]。赵军等[32]研究发现CAFs分泌的外泌体可通过抑制铁死亡促进前列腺癌细胞增殖、迁移和上皮-间质转化(epithelial-mesenchymal transition,EMT),进而调控前列腺癌细胞的发展。此外,肿瘤相关巨噬细胞(tumor associated macrophage,TAM)在促进肿瘤恶性进展和治疗抵抗中发挥关键作用。Luo等[33]在探索TAM在调节肿瘤铁死亡中的作用和机制研究中发现,TAM可抑制宫颈癌细胞铁死亡。具体机制为,巨噬细胞来源的miRNA-660-5p被包装在外泌体中运输到宫颈癌细胞中,减弱花生四烯酸15-脂氧合酶(arachidonate acid 15-lipoxygenase,ALOX15)的表达以抑制铁死亡。由此可见,外泌体参与调控脂质代谢途径来抑制肿瘤铁死亡。此外,巨噬细胞中miRNA-660-5p的上调依赖于自分泌白介素4(interleukin-4,IL-4)/白介素13(interleukin-13,IL-13)激活的信号传导及转录激活因子6(signal transducers and activators of transcription 6,STAT6)通路。鼻咽癌细胞源性外泌体通过巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)增加GPX4的表达,且GPX4的表达与MIF呈正相关。MIF在鼻咽癌细胞中高表达,且由鼻咽癌细胞分泌的外泌体可被巨噬细胞摄取,从而抑制巨噬细胞的铁死亡,促进鼻咽癌的转移[34]。间充质干细胞(mesenchymal stem cells,MSCs)是存在于各种成人组织中的多能基质细胞。研究[13]表明,间充质干细胞分泌的外泌体在肿瘤微环境中作为介质发挥作用,并在肿瘤发生、血管生成和转移中发挥作用。例如,来自间充质干细胞的外泌体可将miR-424转移到肺癌细胞中,从而下调ACSL4的表达并抑制铁死亡[19]。以上研究提示,靶向外泌体介导的肿瘤病理通讯可能为基于铁死亡的抗肿瘤治疗提供一种新的途径。
有研究[35]发现,肺腺癌患者血浆外泌体可特异地降低脂质过氧化,使肺腺癌细胞对铁死亡敏感性下降。其机制是在肺腺癌中,从肿瘤细胞释放的外泌体通过脂肪酸结合蛋白3(fatty acid binding protein 3,FABP3)依赖性降低总体花生四烯酸(arachidonic acid,AA)并防止AA掺入质膜中,增加细胞内cir93使FABP3上调并且使肺腺癌细胞对铁死亡脱敏。外泌体cir93是抑制肺腺癌细胞铁死亡敏感性的关键,阻断外泌体可能有助于未来肺腺癌的治疗。
外泌体参与调控铁死亡介导肿瘤耐药
化学治疗是晚期肿瘤的主要治疗方法,其耐药性一直是肿瘤治疗的主要挑战。化学治疗耐药通常与DNA损伤修复、调节细胞凋亡的分子突变和谷胱甘肽水平升高有关[36-38]。肝细胞癌靶向外泌体(ExoSP94-Lamp2b-RRM)可以特异性地将多重小分子干扰RNA(multi-siRNA)传递到肝细胞癌组织,通过下调GPX4和二氢乳清酸脱氢酶(dihydroorotate dehydrogenase,DHODH)表达,促进索拉非尼诱导的铁死亡,从而提高肝细胞癌对索拉非尼的敏感性。这一发现在铁死亡的角度上为临床克服索拉非尼耐药开辟了新的途径[39]。
已有研究表明,源自CAFs的外泌体介导的miRNA可促进肿瘤转移并增加肿瘤细胞的化学治疗耐药性[40]。在探究外泌体介导的miRNA调节胃癌细胞铁死亡的实验研究中发现,顺铂和紫杉醇通过激活泛素特异性蛋白酶7(ubiquitin-specific protease 7,USP7)/异质性核糖核蛋白A1(heterogeneous nuclear ribonucleoprotein A1,hnRNPA1)轴促进CAFs中miR-522的分泌,抑制ALOX15的表达,并减少胃癌细胞中脂质ROS积累,进而导致化学治疗敏感性降低。研究[41]结果表明,CAFs通过分泌外泌体miR-522,靶向ALOX15并阻断脂质ROS积累来抑制胃癌细胞铁死亡。外泌体可通过影响脂质过氧化物水平调控铁死亡的发生。Qu等[42]研究发现外泌体DACT3-AS1通过靶向miR-181a-5p/sirtuin 1(SIRT1)轴抑制胃癌细胞增殖、迁移和侵袭。此外,DACT3-AS1主要通过外泌体从CAF传递到胃癌细胞。外泌体DACT3-AS1可减缓异种移植物肿瘤生长。体外和体内实验结果均表明,DACT3-AS1通过SIRT1介导的铁死亡使胃癌细胞对奥沙利铂敏感。在肺癌中,外泌体miR-4443的高表达可通过负调控甲基转移酶样蛋白3(methyltransferase-like 3,METTL3)诱导的铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)的m6A修饰,抑制顺铂诱导的铁死亡,赋予肺癌顺铂耐药性。体外研究[43]亦表明,miR-4443的过表达抑制了顺铂治疗诱导的FSP1介导的铁死亡,并促进了体内肿瘤的生长。Qi等[44]研究发现,胰腺导管腺癌中CAF来源的外泌体miRNA在基线时不表现出先天的吉西他滨抗性。但在吉西他滨治疗后,CAF通过分泌外泌体miRNA和维持与肿瘤细胞的信号交流,促进胰腺导管腺癌细胞的化学治疗耐药。具体机制涉及CAF来源的外泌体miR-3173-5p通过海绵化ACSL4抑制肿瘤细胞铁死亡。
肿瘤干细胞(cancer stem cells,CSCs)是一种具有自我更新和不对称分裂特性的肿瘤细胞亚群,与胃癌患者高死亡率和治疗后肿瘤复发有关,是肿瘤复发和耐药的重要原因[45-46]。Zhang等[47]应用质谱技术筛选胃癌组织中铁死亡相关蛋白,超离心分离外泌体lncFERO(exosomallnc-ENDOG-1꞉1),并通过体内和体外研究证明,来自胃癌细胞的外泌体lncFERO与硬脂酰-辅酶A去饱和酶1(stearoyl-CoA desaturase 1,SCD1)的表达呈正相关,并与脂质活性氧负相关。研究结果表明,外泌体lncFERO的分泌可促进SCD1的表达,从而抑制肿瘤干细胞铁死亡,降低胃癌的化学敏感性。外泌体参与调控铁死亡介导肿瘤作用机制总结见表1。外泌体调控肿瘤铁死亡的机制见图1。
| 外泌体 | 肿瘤类型 | 作用机制 | 调控铁死亡 | 对肿瘤的影响 |
|---|---|---|---|---|
| miR-144-3p | 骨肉瘤 | ZEB1↓ | 诱导 | 抑制细胞增殖、迁移和侵袭 |
| miR-217 | 膀胱癌 | ACSL4↓、GPX4↑、SLC7A11↑ | 抑制 | 抑制细胞凋亡 |
| GOT1 | 胰腺癌 | CCR2↑、Nrf2/HO-1轴↑ | 抑制 | 促进肿瘤生长 |
| miR-3173-5p | ACSL4↓ | 抑制 | 增强吉西他滨耐药性 | |
| miR -22-3p | 肺癌、骨肉瘤 | ACSL4↓ | 抑制 | 促进肿瘤生长 |
| CAFs-exo | 前列腺癌 | GPX4↑、Nrf2↓ 、ACSL4↓ | 抑制 | 促进细胞增殖、迁移和EMT |
| miRNA-660-5p | 宫颈癌 | ALOX15↓ | 抑制 | 抑制细胞死亡 |
| cir93 | 肺腺癌 | AA↓,NAT↑ | 抑制 | 使细胞对铁死亡脱敏 |
| ExoSP94-Lamp2b-RRM | 肝细胞癌 | GPX4↓,DHODH↓ | 增强 | 提高索拉非尼的敏感性 |
| miR-522 | 胃癌 | ALOX15↓,ROS↓ | 抑制 | 降低顺铂和紫杉醇的化学治疗敏感性 |
| DACT3-AS1 | SIRT1↑ | 诱导 | 增强奥沙利铂敏感性 | |
| lncFERO | SCD1↑ | 抑制 | 降低化学治疗敏感性 | |
| miR-4443 | 肺癌 | FSP1 m6A↓ | 抑制 | 促进肿瘤生长,增强顺铂耐药性 |
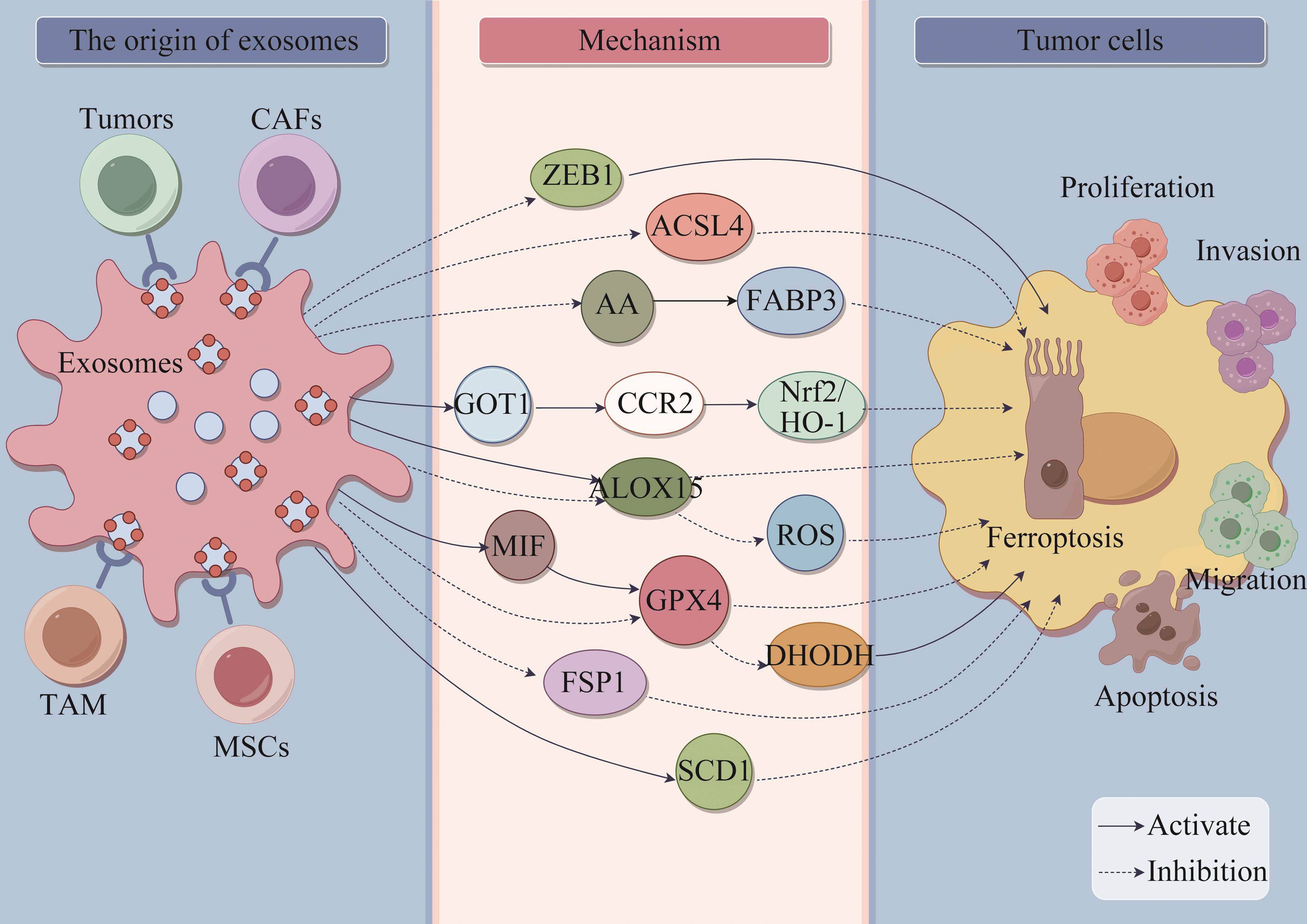
外泌体调控铁死亡在肿瘤疾病的应用研究
外泌体可与细胞膜相互作用并将药物输送到细胞中[48-49]。因此,外泌体作为药物传递载体得到越来越多的研究。实验工程外泌体具有巨大的治疗潜力。Du等[50]研究发现由CD47、铁死亡诱导剂erastin和Rose Bengal组成的工程外泌体在肝细胞癌中可明显诱导铁死亡,且对肝脏和肾脏的毒性很小。针对铁死亡的叶酸(folic acid,FA)修饰外泌体可用于临床应用。Yu等[51]开发了一种装载erastin的外泌体配方,与FA结合,形成装载erastin的FA矢量外泌体(erastin@ FA‐exo),以靶向FA受体过表达的三阴性乳腺癌细胞。结果表明,erastin@FA‐exo比erastin@exo和free erastin更有效地抑制GPX4和上调半胱氨酸双加氧酶1(cysteine dioxygenase type 1,CDO1)的表达,同时erastin@FA‐exo明显降低三阴性乳腺癌细胞MDA-MB-231的线粒体膜电位,抑制肿瘤Warburg现象,促进肿瘤细胞中氧自由基的生成。综上所述,erastin@FA‐exo可以主动和选择性地靶向MDA-MB-231细胞,并有效地诱导肿瘤细胞铁死亡。这为外泌体用于治疗各种类型的恶性肿瘤提供一种有希望的策略。
在胶质母细胞瘤中,血脑屏障(blood brain barrier,BBB)药物渗透性差一直是影响肿瘤治疗效果的主要障碍。外泌体经修饰后携带angiopep-2多肽,可触发细胞渗透,不仅具有穿透血脑屏障的能力,还可通过识别低密度脂蛋白受体相关蛋白1(low density lipoprotein receptor related protein 1,LRP 1)受体并靶向胶质母细胞瘤细胞,从而增强铁死亡[52]。Hu等[31]开发了一种可同时靶向肿瘤实质细胞和基质细胞且易于大量制备的外泌体样肿瘤疫苗,即成纤维细胞活化蛋白(fibroblast activation protein,FAP)基因工程肿瘤细胞源性外泌体样纳米囊泡(eNVs-FAP)。同时,该疫苗在结肠癌、黑色素瘤、肺癌、乳腺癌等多种荷瘤小鼠模型中均有抗肿瘤作用。实验结果表明,针对肿瘤细胞和CAFs的eNVs-FAP疫苗通过募集效应T细胞和减少免疫抑制细胞的比例来抑制肿瘤生长,而且eNVs-FAP诱导的抗肿瘤免疫可促进肿瘤铁死亡。此外,FAP和CAFs可能参与调节肿瘤铁死亡。肿瘤疫苗与铁死亡诱导剂联合使用进一步增强了抗肿瘤效果。以上结果提示eNVs-FAP是一种同时靶向肿瘤实质和间质的候选肿瘤疫苗。这些结果表明外泌体和铁死亡诱导剂联合用于肿瘤治疗具有良好的临床应用潜力。
ITM是影响临床免疫治疗的一个障碍。程序性死亡配体1(programmed death-ligand 1,PD-L1)分泌过多导致程序性死亡受体1(programmed death-1,PD-1)/PD-L1免疫治疗的耐药和临床失败。应用抗外泌体PD-L1治疗可恢复T细胞功能,诱导恶性黑色素瘤细胞铁死亡,从而缓解抗肿瘤免疫抑制[53]。Wang等[54]研究了外泌体PD-L1与肿瘤铁死亡之间的关系,开发了HACAFe@GW4869纳米颗粒(HGF NPs),将外泌体抑制剂(GW4869)与铁死亡诱导剂(Fe3+)结合在一起,以刺激黑色素瘤细胞的抗肿瘤反应。研究结果表明,GW4869可抑制外泌体PD-L1的分泌,从而触发T细胞活化并促进干扰素γ((Interferon-γ,IFN-γ)的分泌。IFN-γ抑制肿瘤细胞胞浆中的溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)和SLC3A2的表达,降低胱氨酸和GSH水平,抑制GPX4表达,从而促进黑色素瘤细胞铁死亡。综上所述,靶向抗外泌体治疗与全身抗PD-L1治疗协同作用,对高度转移性肿瘤产生强大的全身免疫反应。
纳米囊泡可能会遭受挤压而引起结构损伤并导致部分物质和功能损失,与之相比,巨噬细胞遗传外泌体工程可以保留更多的功能和遗传物质。Wang等[55]成功构建装载RSL3的外泌体和M1巨噬细胞来源性外泌体RSL3-Exo。RSL-Exo中获得的外泌体遗传自亲本M1巨噬细胞,经体外和体内验证可自发归巢到肿瘤并在肿瘤中积累,且能显著促进致瘤蛋白M2型巨噬细胞向抗肿瘤M1样巨噬细胞转化,降低Tregs以减轻ITM。高积累和减轻的ITM使RSL3-Exo通过激活和增强系统免疫反应和调节铁死亡相关蛋白的表达进而促进铁死亡,抑制4T1肿瘤进展。生物相容性M1-Exo工程策略可以成功地消除肿瘤免疫抑制,加速免疫激活的乳腺肿瘤铁死亡。外泌体调控铁死亡在肿瘤疾病的应用研究总结见表2。
| 外泌体应用模式 | 肿瘤类型 | 作用机制 | 优势 |
|---|---|---|---|
| erastin@ FA‐exo纳米给药 | 乳腺癌 | GPX4↓,CDO1↑,Warburg↓ | 主动和选择性地靶向肿瘤细胞,并有效地诱导细胞铁死亡 |
| HGF NPs纳米技术 | 黑色素瘤 | IFN-γ↑,SLC7A11、SLC3A2、胱氨酸、GSH、GPX4↓ | 弥补游离抗体局限性,增强全身免疫反应 |
| M1巨噬细胞遗传外泌体装载RSL3(RSL3-Exo) | 结直肠癌 | Tregs、ITM↓ | 生物安全性较高,减轻ITM、消除肿瘤免疫抑制,加速激活免疫反应 |
| 工程外泌体偶联磁性纳米颗粒 | 胶质母细胞瘤 | 穿透BBB,识别LRP-1 | 精准治疗特定位置,靶向胶质母细胞瘤细胞,增强铁死亡 |
| eNVs-FAP疫苗 | 肠癌、黑色素瘤、肺癌、乳腺癌等 | 募集效应T细胞和减少免疫抑制细胞的比例 | 同时靶向肿瘤实质和间质肿瘤,诱导抗肿瘤免疫,促进肿瘤铁死亡 |
综上所述,不同的组织源性外泌体通过不同的途径诱导抑制铁死亡。有关外泌体参与调控肿瘤铁死亡的研究发现,外泌体传递不同的生物活性物质来可通过促进或抑制肿瘤细胞的铁死亡进而调节细胞增殖、免疫反应和肿瘤微环境,这些观点提高了广大学者对肿瘤化学治疗耐药的认识,并为临床肿瘤治疗提供了实验依据。外泌体作为一种药物传递系统已成为当前研究的一个热门课题。目前对装载抗癌药物靶向铁死亡的外泌体的研究目前作用有限,未来可能会开发出针对不同铁死亡途径的其他抗肿瘤药物。这些领域的研究进展都证明了外泌体通过诱导或抑制铁死亡对肿瘤的治疗具有重要作用,可能成为新的靶点。
结语与展望
目前关于外泌体参与调控铁死亡在肿瘤中的研究仍有不足之处。例如,部分实验样本规模相对较小且多是动物模型和细胞实验,需要进一步临床试验来验证研究的准确性,确定是否会有相同的结果。还有其他一些临床特征(如肿瘤分期)对铁死亡调控的影响尚未得到证实,外泌体是否可在患病的不同阶段应用尚需要更全面、更深层次的基础和临床研究。此外,外泌体参与调控铁死亡的上游、下游机制尚未完全明确,并且在肿瘤的应用研究等领域的相关文献较少,该疗法的优势与缺点也尚未完全明确。尽管如此,利用外泌体的运送载体特性调控铁死亡为临床抗肿瘤治疗提供了更多的可能性,该研究方向具有较大的研究价值和应用潜力。未来需要开展更多的深入研究,进一步揭示和阐述外泌体、铁死亡与肿瘤之间的关系,以获得更全面的外泌体参与抑制铁死亡的分子机制,从而有可能改善肿瘤患者的治疗。外泌体参与调控铁死亡抑制肿瘤发展有望为更有效的临床治疗肿瘤新模式提供途径和思路。
The biology, function, and biomedical applications of exosomes
[J]. Science, 2020, 367(6478):Exosomal circRNAs: biogenesis, effect and application in human diseases
[J]. Mol Cancer, 2019, 18(1): 116. https://doi.org/10.1186/s12943-019-1041-z.Exosome-based delivery of natural products in cancer therapy
[J]. Front Cell Dev Biol, 2021, 9: 650426. https://doi.org/10.3389/fcell.2021.650426.Dendritic cell exosomes directly kill tumor cells and activate natural killer cells via TNF superfamily ligands
[J]. Oncoimmunology, 2012, 1(7): 1074-1083. https://doi.org/10.4161/onci.20897.Osteosarcoma cell-derived exosomes affect tumor microenvironment by specific packaging of microRNAs
[J]. Carcinogenesis, 2020, 41(5): 666-677. https://doi.org/10.1093/carcin/bgz130.Progression of osteosarcoma from a non-metastatic to a metastatic phenotype is causally associated with activation of an autocrine and paracrine uPA axis
[J]. PLoS One, 2015, 10(8):Exosome mediated communication within the tumor microenvironment
[J]. J Control Release, 2015, 219: 278-294. https://doi.org/10.1016/j.jconrel.2015.06.029.The role of exosomes and their applications in cancer
[J]. Int J Mol Sci, 2021, 22(22): 12204. https://doi.org/10.3390/ijms222212204.Gastric cancer derived exosomes mediate the delivery of circRNA to promote angiogenesis by targeting miR-29a/VEGF axis in endothelial cells
[J]. Biochem Biophys Res Commun, 2021, 560: 37-44. https://doi.org/10. 1016/j.bbrc.2021.04.099.Transferred by exosomes-derived miR-19b-3p targets PTEN to regulate esophageal cancer cell apoptosis, migration and invasion
[J]. Biosci Rep, 2020, 40(11):Breast cancer-derived exosomes regulate cell invasion and metastasis in breast cancer via miR-146a to activate cancer associated fibroblasts in tumor microenvironment
[J]. Exp Cell Res, 2020, 391(2): 111983. https://doi.org/10.1016/j.yexcr.2020.111983.CAFs secreted exosomes promote metastasis and chemotherapy resistance by enhancing cell stemness and epithelial-mesenchymal transition in colorectal cancer
[J]. Mol Cancer, 2019, 18(1): 91. https://doi.org/10.1186/s12943-019-1019-x.Mesenchymal stem cell exosomes: a two-edged sword in cancer therapy
[J]. Int J Nanomedicine, 2019, 14: 2847-2859. https://doi.org/10.2147/IJN. S200036Regulation of ferroptotic cancer cell death by GPX4
[J]. Cell, 2014, 156(1/2): 317-331. https://doi.org/10.1016/j.cell.2013.12.010.Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice
[J]. Nat Cell Biol, 2014, 16(12): 1180-1191. https://doi.org/10. 1038/ncb3064.Glutaminolysis and transferrin regulate ferroptosis
[J]. Mol Cell, 2015, 59(2): 298-308. https://doi.org/10.1016/j.molcel.2015.06.011.Tau-mediated iron export prevents ferroptotic damage after ischemic stroke
[J]. Mol Psychiatry, 2017, 22(11): 1520-1530. https://doi.org/10.1038/mp. 2017.171.Ferroptosis in cancer progression: role of noncoding RNAs
[J]. Int J Biol Sci, 2022, 18(5): 1829-1843. https://doi.org/10.7150/ijbs.66917.Relationship between miRNA and ferroptosis in tumors
[J]. Front Pharmacol, 2022, 13: 977062. https://doi.org/10.3389/fphar.2022.977062.Ferroptosis: a novel anti-tumor action for cisplatin
[J]. Cancer Res Treat, 2018, 50(2): 445-460. https://doi.org/10.4143/crt.2016.572.Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis
[J]. Hepatology, 2016, 64(2): 488-500. https://doi.org/10.1002/hep. 28574.CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy
[J]. Nature, 2019, 569(7755): 270-274. https://doi.org/10.1038/s41586-019-1170-y.Exosomes in cancer development
[J]. Curr Opin Genet Dev, 2021, 66: 83-92. https://doi. org/10.1016/j.gde.2020.12.018.Biomolecular characterization of exosomes released from cancer stem cells: possible implications for biomarker and treatment of cancer
[J]. Oncotarget, 2015, 6(5): 3280-3291. https://doi.org/10.18632/oncotarget.2462.Exosome-mediated miR-144-3p promotes ferroptosis to inhibit osteosarcoma proliferation, migration, and invasion through regulating ZEB1
[J]. Mol Cancer, 2023, 22(1): 113. https://doi.org/10.1186/s12943-023-01804-z.Bladder cancer tissue-derived exosomes suppress ferroptosis of T24 bladder cancer cells by transporting miR-217
[J]. Environ Mol Mutagen, 2023, 64(1): 39-49. https://doi.org/10.1002/em.22520.Tumor cell derived exosomal GOT1 suppresses tumor cell ferroptosis to accelerate pancreatic cancer progression by activating Nrf2/HO-1 axis via upregulating CCR2 expression
[J]. Cells, 2022, 11(23): 3893. https://doi.org/10.3390/cells11233893.Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure
[J]. Signal Transduct Target Ther, 2023, 8(1): 121. https://doi.org/10.1038/s41392-023-01336-4.Tumor morphology and phenotypic evolution driven by selective pressure from the microenvironment
[J]. Cell, 2006, 127(5): 905-915. https://doi.org/10.1016/j.cell.2006.09.042.Stromal microenvironment shapes the intratumoral architecture of pancreatic cancer
[J]. Cell, 2019, 178(1): 160-175.e27. https://doi. org/10.1016/j.cell.2019.05.012.Engineered exosome-like nanovesicles suppress tumor growth by reprogramming tumor microenvironment and promoting tumor ferroptosis
[J]. Acta Biomater, 2021, 135: 567-581. https://doi.org/10.1016/j.actbio. 2021.09.003.癌相关成纤维细胞外泌体通过抑制铁死亡促进前列癌恶性侵袭
[J]. 中国肿瘤外科杂志, 2023, 15(2): 133-140. https://doi.org/10.3969/j.issn.1674-4136.2023.02.006.The suppression of cervical cancer ferroptosis by macrophages: the attenuation of ALOX15 in cancer cells by macrophages-derived exosomes
[J]. Acta Pharm Sin B, 2023, 13(6): 2645-2662. https://doi.org/10.1016/j.apsb.2023.03.025.Exosomal MIF derived from nasopharyngeal carcinoma promotes metastasis by repressing ferroptosis of macrophages
[J]. Front Cell Dev Biol, 2021, 9: 791187. https://doi.org/10.3389/fcell.2021.791187.Dual disruption of aldehyde dehydrogenases 1 and 3 promotes functional changes in the glutathione redox system and enhances chemosensitivity in nonsmall cell lung cancer
[J]. Oncogene, 2020, 39(13): 2756-2771. https://doi.org/10. 1038/s41388-020-1184-9.The balance between NRF2/GSH antioxidant mediated pathway and DNA repair modulates cisplatin resistance in lung cancer cells
[J]. Sci Rep, 2019, 9(1): 17639. https://doi.org/10.1038/s41598-019-54065-6.外源性外泌体在细胞凋亡中的调控作用
[J]. 中南大学学报(医学版), 2017, 42(2): 215-220. https://doi.org/10. 11817/j.issn.1672-7347.2017.02.016.Designer exosomes for targeted delivery of a novel therapeutic cargo to enhance sorafenib-mediated ferroptosis in hepatocellular carcinoma
[J]. Front Oncol, 2022, 12: 898156. https://doi.org/10.3389/fonc.2022. 898156.Exosomal miR-196a derived from cancer-associated fibroblasts confers cisplatin resistance in head and neck cancer through targeting CDKN1B and ING5
[J]. Genome Biol, 2019, 20(1): 12. https://doi.org/10.1186/s13059- 018-1604-0.CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer
[J]. Mol Cancer, 2020, 19(1): 43. https://doi.org/10.1186/s12943-020-01168-8.Loss of cancer-associated fibroblast-derived exosomal DACT3-AS1 promotes malignant transformation and ferroptosis-mediated oxaliplatin resistance in gastric cancer
[J]. Drug Resist Updat, 2023, 68: 100936. https://doi.org/10.1016/j.drup.2023.100936.Exosomal miR-4443 promotes cisplatin resistance in non-small cell lung carcinoma by regulating FSP1 m6A modification-mediated ferroptosis
[J]. Life Sci, 2021, 276: 119399. https://doi.org/10.1016/j.lfs.2021. 119399.Cancer-associated fibroblasts suppress ferroptosis and induce gemcitabine resistance in pancreatic cancer cells by secreting exosome-derived ACSL4-targeting miRNAs
[J]. Drug Resist Updat, 2023, 68: 100960. https://doi.org/10.1016/j.drup.2023.100960.Verteporfin targeting YAP1/TAZ-TEAD transcriptional activity inhibits the tumorigenic properties of gastric cancer stem cells
[J]. Int J Cancer, 2020, 146(8): 2255-2267. https://doi.org/10.1002/ijc. 32667.Targeting cancer stem cell pathways for cancer therapy
[J]. Signal Transduct Target Ther, 2020, 5(1): 8. https://doi.org/10.1038/s41392-020-0110-5.Chemotoxicity-induced exosomal lncFERO regulates ferroptosis and stemness in gastric cancer stem cells
[J]. Cell Death Dis, 2021, 12(12): 1116. https://doi.org/10.1038/s41419-021-04406-z.Ectosomes and exosomes: shedding the confusion between extracellular vesicles
[J]. Trends Cell Biol, 2015, 25(6): 364-372. https://doi.org/10.1016/j.tcb.2015. 01.004.Exosomes in development, metastasis and drug resistance of breast cancer
[J]. Cancer Sci, 2015, 106(8): 959-964. https://doi.org/10.1111/cas.12715.Designer exosomes for targeted and efficient ferroptosis induction in cancer via chemo-photodynamic therapy
[J]. Theranostics, 2021, 11(17): 8185-8196. https://doi.org/10.7150/thno.59121.Targeted exosome-encapsulated erastin induced ferroptosis in triple negative breast cancer cells
[J]. Cancer Sci, 2019, 110(10): 3173-3182. https://doi.org/10. 1111/cas.14181.Synchronous disintegration of ferroptosis defense axis via engineered exosome-conjugated magnetic nanoparticles for glioblastoma therapy
[J]. Adv Sci, 2022, 9(17):Phototheranostic metal-phenolic networks with antiexosomal PD-L1 enhanced ferroptosis for synergistic immunotherapy
[J]. J Am Chem Soc, 2022, 144(2): 787-797. https://doi.org/10.1021/jacs.1c09753.A nanounit strategy reverses immune suppression of exosomal PD-L1 and is associated with enhanced ferroptosis
[J]. Nat Commun, 2021, 12(1): 5733. https://doi.org/10.1038/s41467-021-25990-w.Macrophage-inherited exosome excise tumor immunosuppression to expedite immune-activated ferroptosis
[J]. J Immunother Cancer, 2023, 11(5):作者声称无任何利益冲突。
徐瑞雪, 王宇. 外泌体参与调控肿瘤铁死亡作用机制的研究进展[J]. 中南大学学报(医学版), 2024, 49(10): 1683-1691. DOI:10.11817/j.issn.1672-7347.2024.230595
XU Ruixue, WANG Yu. Research progress on the mechanism of exosomes involved in the regulation of tumor ferroptosis[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1683-1691. DOI:10.11817/j.issn.1672-7347. 2024.230595
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101683.pdf
http://dx.chinadoi.cn/

