心血管疾病危害着人类的身体健康,特别是心力衰竭,导致几十万人生活受到影响[1-2]。心室重构及病理性心肌肥厚是心力衰竭的始动因素[3-4]。但目前心肌重构的发病机制仍不完全清楚,且心力衰竭的治疗手段有限[5]。因此探讨心肌重构的发生发展机制及治疗方案可为心力衰竭带来多元化的选择。研究证实组蛋白甲基化酶EZH2与心脏左心室发育及左心室心肌重构关系密切[6-8];且组蛋白甲基化修饰失衡参与了病理性心肌重构[9]。但EZH2介导的组蛋白第27位赖氨酸甲基化组蛋白H3(H3K27me3)甲基化异常在压力过载性心肌重构中的调控作用并不十分清楚。因此,本研究通过构建小鼠压力过载性心肌重构模型来探讨EZH2介导的组蛋白H3K27me3甲基化修饰失衡在病理性心肌重构中的作用及机制,为病理性心肌重构的防治提供新靶点。
材料和方法
材料
实验动物及分组
选取6~8周龄SPF级昆明雄性小鼠36只,体重30±5 g,由遵义医科大学动物中心提供,动物许可证号:SCXK(黔)2018-0002。按照随机数字表法将小鼠分为:正常组(Normal)、假手术组(Sham)、胸主动脉缩窄(TAC)组(包括TAC术后4周和8周)、溶剂对照组(TAC+Veh)、TAC+Tan I组,每组6只小鼠。参照之前课题组建模方法[10],TAC组部分结扎胸主动脉,假手术组只分离不结扎,溶剂对照组给予等量双纯水灌胃,TAC+Tan I组部分结扎胸主动脉后3天给予EZH2抑制剂(Tan I)30 mg/(kg·d)灌胃,连续给药至术后8周。正常组未给予任何处理。收集术后4周及8周小鼠心脏进行检测。
主要试剂与仪器
抗H3K27me3抗体、抗EZH2抗体及抗β-MHC抗体;抗β-actin、H3抗体及HRP标记二抗(proteintech,中国);SDS-PAGE凝胶试剂(索莱宝,中国);WGA染色试剂盒(Genetex,美国);Vevo 2100超声心动仪(Visualsonics,加拿大);Bio-Rad酶标仪;Bio-Rad电泳仪;莱卡RM2245组织切片机。
方法
构建小鼠 TAC 模型
小鼠术前禁食禁饮,术前腹腔注射戊巴比妥进行全身麻醉,通过翻正反射和足蹬撤退反射的消失来确定麻醉程度。在相对无菌环境下,剪开小鼠胸骨,分离双侧胸腺(避免损伤周围组织),充分暴露主动脉弓,然后手术缝合线结扎主动脉弓部(结扎范围约为胸主动脉直径75%),逐层缝合关闭胸腔。术后连续3天腹腔注射青霉素(15万单位/只)预防感染,术后均自由进食进水。
免疫印迹(Western blot,WB)检测
应用蛋白提取试剂盒提取心肌组中蛋白,BCA 法检测蛋白浓度,6%、10%及15% SDS-PAGE凝胶分离蛋白,半干转及湿转膜,将PVDF膜浸泡于5%脱脂牛奶中封闭2 h,分别加入兔来源抗H3K27me3、EZH2、β-MHC抗体,4 ℃孵12 h,洗膜缓冲液(TBST)洗膜,每次10 min,洗涤3次,加入山羊抗兔二抗孵育,室温摇床孵育1 h,TBST洗涤,每次 10 min,洗涤3次,使用化学发光试剂显影。采用Bio-Rad图像分析仪进行图像扫描。
超声心动仪检测
10%水合氯醛腹腔注射镇静小鼠后,应用Vevo 2100超声仪检测小鼠心脏左室收缩末期直径(Left ventricular end-systolic diameter,LVESD)、左室舒张末期直径(Left ventricular end-diastolic diameter,LVEDD)、左室射血分数(Left ventricular ejection fraction,LVEF)、左室前壁厚度(Left ventricular anterior wall thickness,LVAWT)和左室后壁厚度(Left ventricular posterior wall thickness,LVPWT)。
统计学分析
采用SPSS 18.0版本统计软件进行统计学分析。所有数据用均数±标准差表示,多组间比较采用单因素方差分析,组间均数比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
超声心动图检测建TAC小鼠模型
超声心动图显示:假手术组小鼠胸主动脉弓降部无狭窄、超声多普勒提示血流通过主动脉弓降部顺畅(图1A),且血流速度正常(图1B)。TAC组模型小鼠主动脉弓降部明显变窄(图1C)、超声多普勒提示血流通过胸主动脉弓降部受阻,血流速度增快(图1D);TAC组小鼠胸主动脉直径和胸主动脉血液流速与假手术组相比有显著差异(P<0.05)(图1E和F)。
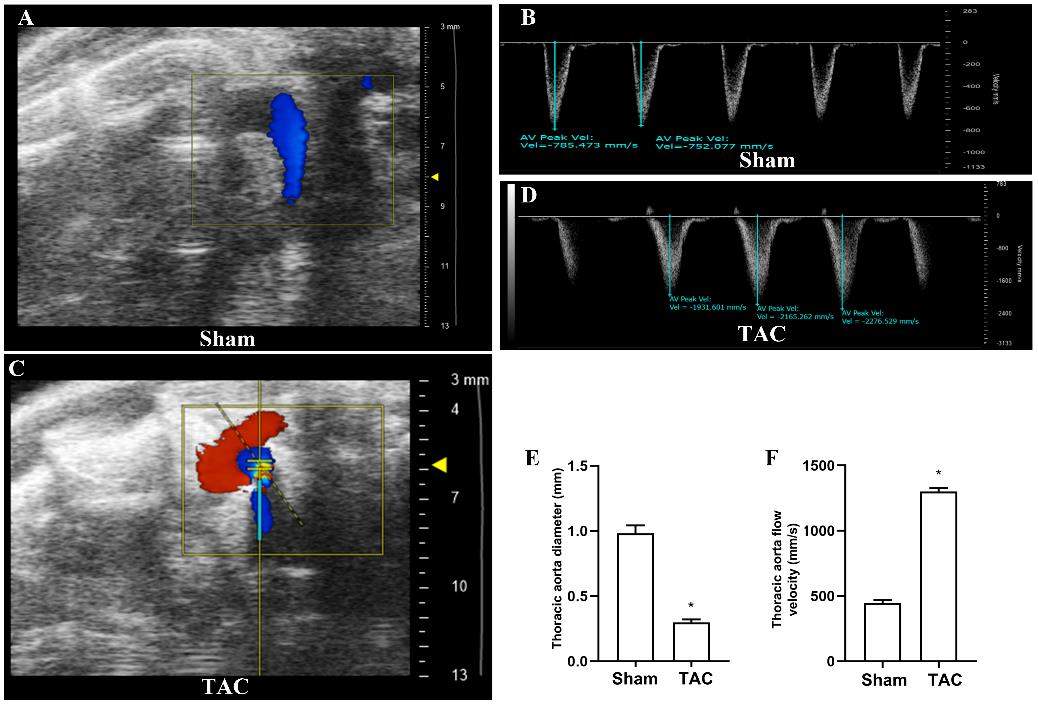
超声检测各组小鼠心脏各项指标
超声心动图显示:TAC组小鼠术后4周时出现左心室肥厚,术后8周时出现左心室变薄(图2)。TAC术后4周,与假手术组相比TAC组小鼠LVAWT、LVPWT、LVEF明显升高(P<0.05),而TAC术后8周时上述指标则显著降低(P<0.05);但TAC组小鼠LVEDD、LEVSD在术后4周时较假手术组明显降低(P<0.05),而术后8周时则显著升高(P<0.05)。TAC组在术后4周时LVV较假手术组明显减小(P<0.05),术后8周时明显增加(P<0.05)(表1)。
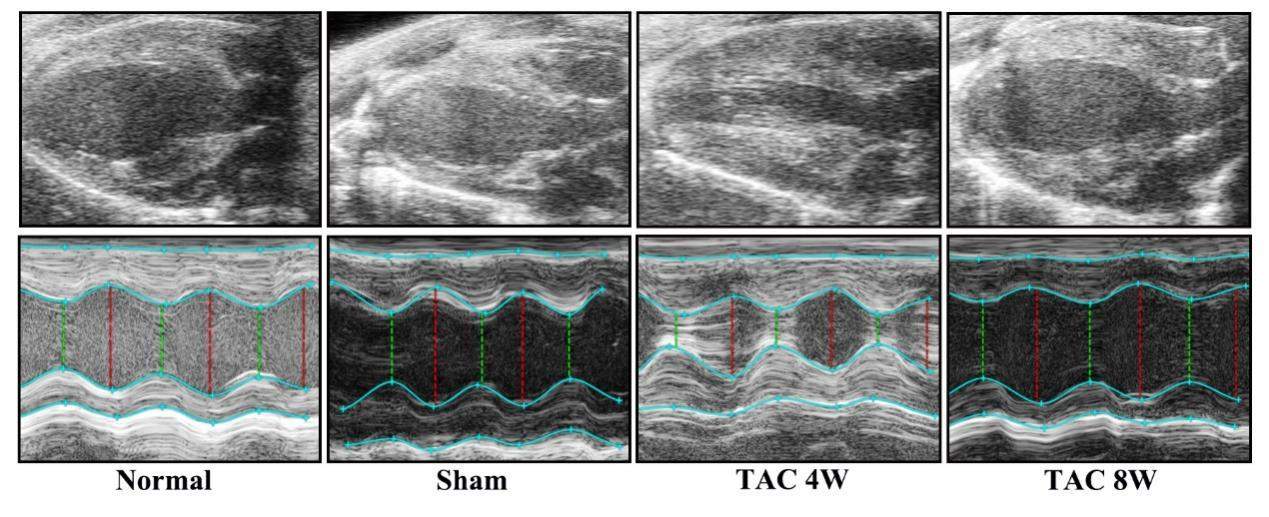
| Normal | Sham | TAC 4W | TAC 8W | P value | |
|---|---|---|---|---|---|
| Parameters | |||||
| Body weight/g | 38.45±0.29 | 38.66±0.22 | 39.15±0.18 | 38.40±0.60 | 0.29 |
| Heart rate/bpm | 464±2 | 463±4 | 468±2 | 474±3 | 0.12 |
| LV end diastole | |||||
| LVAWT/mm | 1.05±0.33 | 1.04±0.25 | 1.62±0.13* | 1.12±0.04 | 0.00 |
| LVPWT/mm | 1.24±0.31 | 1.36±0.05 | 1.88±0.23* | 1.02±0.39 | 0.00 |
| LVEDD/mm | 3.82±0.36 | 3.64±0.23 | 2.87±0.82 | 4.02±0.59* | 0.00 |
| LV volume/μL | 55.38±0.55 | 58.33±0.44 | 75.31±0.15 | 106.00±1.20* | 0.00 |
| LV end systole | |||||
| LVAWT/mm | 1.84±0.10 | 1.76±0.22 | 2.38±0.30* | 1.67±0.05 | 0.00 |
| LVPWT/mm | 1.82±0.25 | 1.95±0.28 | 2.51±0.15 | 1.36±0.15* | 0.18 |
| LVESD/mm | 2.14±0.83 | 1.87±0.52 | 0.81±0.64 | 3.98±0.32* | 0.00 |
| LV volume/μL | 25.17±0.16 | 22.92±0.57 | 15.08±0.83 | 53.68±0.25* | 0.00 |
| EF/% | 78.00±5.28 | 82.00±3.00 | 91.53±3.57 | 68.55±2.16* | 0.00 |
TAC小鼠心肌组织中EZH2、H3K27me3及β- MHC表达水平
WB结果显示,TAC术后4周和8周,TAC组小鼠心肌组织中组蛋白甲基化酶EZH2表达水平及组蛋白H3K27me3甲基化水平较假手术组显著降低(P<0.05)(图3A和B);但TAC组小鼠心肌组织中β-MHC表达水平较假手术组明显升高(P<0.05)(图3C)。
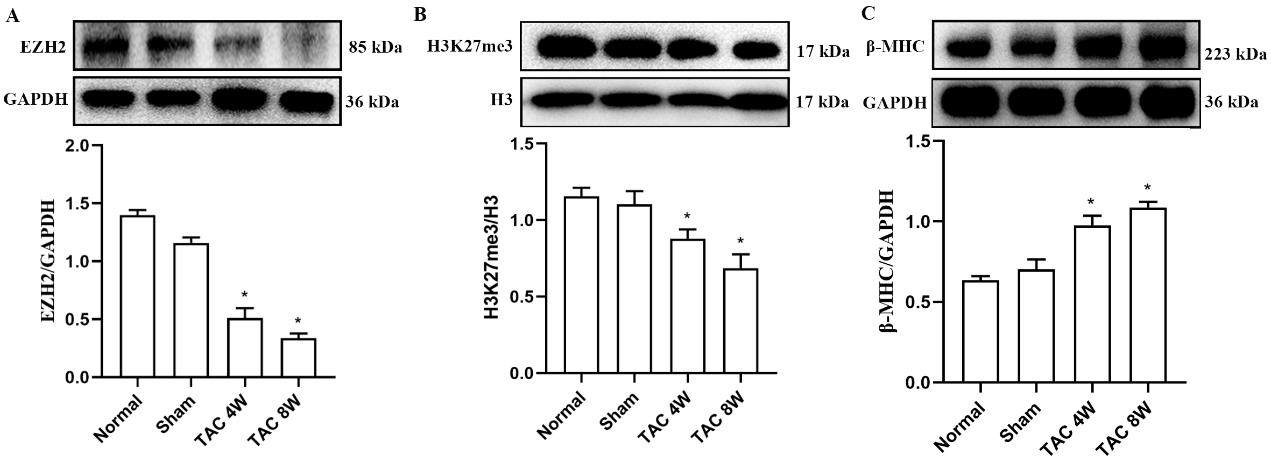
EZH2抑制剂(Tan I)对TAC小鼠心脏各项指标的影响
体视镜显示,TAC术后8周小鼠心脏形态较假手术组增大,TAC+Tan I组小鼠心脏外观较TAC组增大(图4A)。同时,术后8周TAC组心脏指数较假手术组显著增加(P<0.05),且TAC+Tan I组小鼠心脏指数较 TAC组亦显著增加(P<0.05)(图4B)。超声心动图显示术后8周TAC组心室壁较假手术组变薄(P<0.05),而TAC+Tan I组较TAC组心室壁变薄(P<0.05)(图4C)。同时,术后8周TAC组小鼠LVEDD、LVESD、LVV均显著高于假手术组(P<0.05);与TAC组相比较,EZH2抑制剂(Tan I)亦能显著增加小鼠LVEDD、LVESD、LVV(P<0.05)。术后8周TAC组小鼠LVAWT、LVPWT、LVEF均显著低于假手术组(P<0.05);与TAC组比较,EZH2抑制剂(Tan I)能进一步降低小鼠LVAWT、LVPWT、LVEF(P<0.05)(表2)。
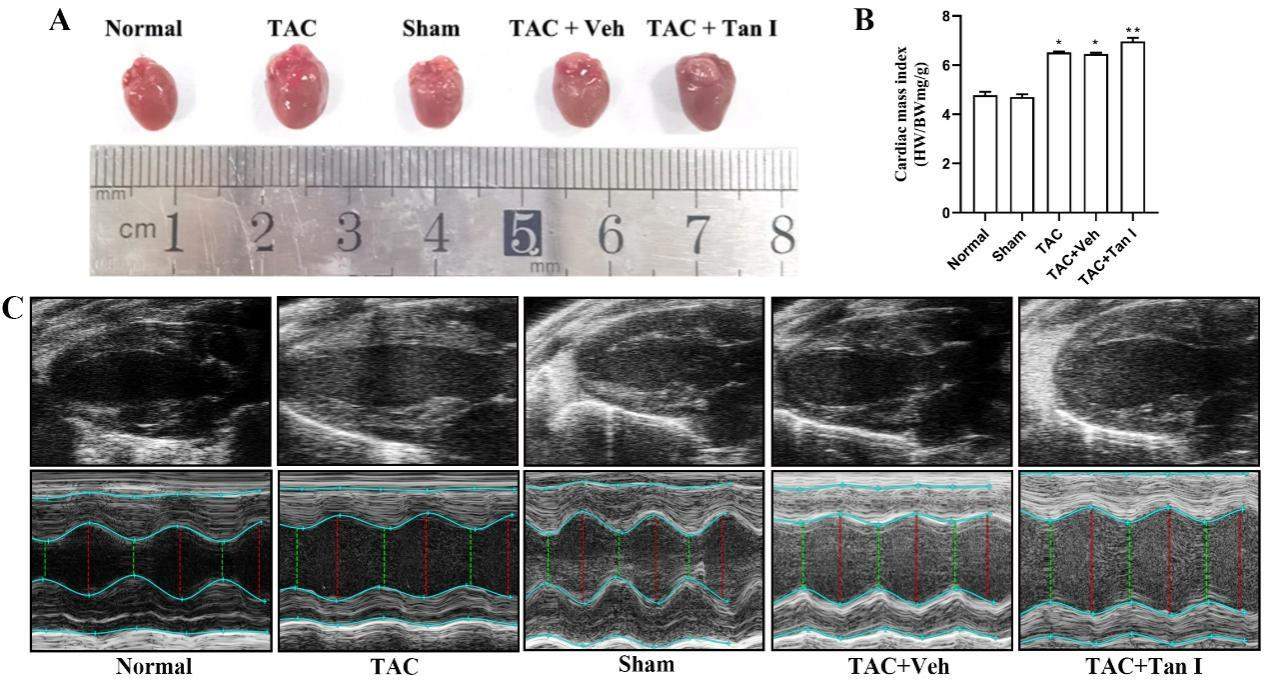
| Normal | Sham | TAC | TAC+Tan I | TAC+Veh | P value | |
|---|---|---|---|---|---|---|
| Parameters | ||||||
| BW/g | 38.48±1.26 | 38.36±0.53 | 38.22±0.13 | 38.12±0.18 | 38.26±0.31 | 0.15 |
| HR/bpm | 462±2 | 463±4 | 466±4 | 472±6 | 463±6 | 0.13 |
| LV end diastole | ||||||
| LVAWT/mm | 1.06±0.10 | 1.04±0.13 | 1.28±0.25* | 1.04±0.10† | 1.32±0.12 | 0.00 |
| LVPWT/mm | 1.12±0.05 | 1.10±0.08 | 0.94±0.08* | 0.98±0.03† | 0.92±0.12 | 0.00 |
| LVEDD/mm | 3.89±0.11 | 3.75±0.21 | 4.13±0.16* | 4.38±0.21† | 3.92±0.14 | 0.00 |
| LV volume/μL | 62.32±0.45 | 63.22±0.38 | 72.15±0.32* | 88.28±0.15† | 75.55±0.22 | 0.00 |
| LV end systole | ||||||
| LVAWT/mm | 1.87±0.15 | 1.92±0.20 | 1.61±0.08* | 1.22±0.24† | 1.71±0.04 | 0.00 |
| LVPWT/mm | 1.52±0.05 | 1.55±0.19 | 1.36±0.15 | 1.12±0.15† | 1.37±0.10 | 0.19 |
| LVESD/mm | 2.26±0.03 | 2.24±0.07 | 2.82±0.13* | 3.58±0.04† | 2.88±0.08 | 0.00 |
| LV volume/μL | 23.63±0.76 | 25.88±0.53 | 48.38±0.89* | 60.21±0.57† | 46.15±1.02 | 0.00 |
| LVEF/% | 76.91±3.52 | 75.82±2.97 | 61.00±5.29* | 54.33±3.48† | 64.32±4.16 | 0.00 |
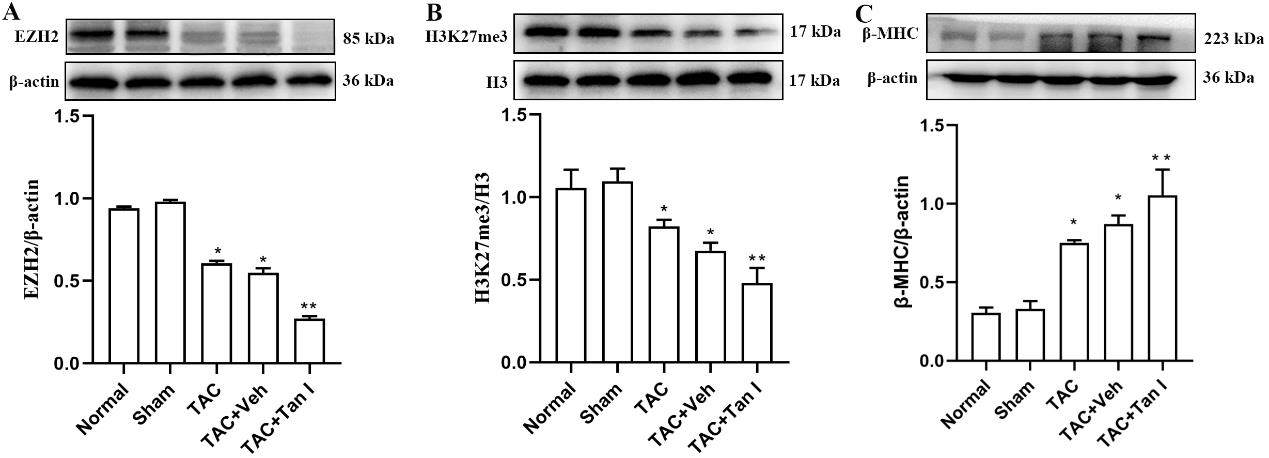
EZH2抑制剂(Tan I )对TAC小鼠心肌组织中EZH2、H3K27me3及β-MHC表达水平的影响
WB 结果显示,术后8周TAC组小鼠心肌组织中 EZH2 的表达水平及组蛋白H3K27me3甲基化水平较假手术组显著降低(P<0.05),而TAC+Tan I组小鼠心肌组织中EZH2表达水平及H3K27me3甲基化水平较TAC组显著降低(P<0.05)(图5A和B)。同时,心肌肥厚标志物β-MHC表达水平在术后8周TAC组较假手术组显著升高(P<0.05),而TAC+Tan I组较TAC组显著升高(P<0.05)(图5C)。
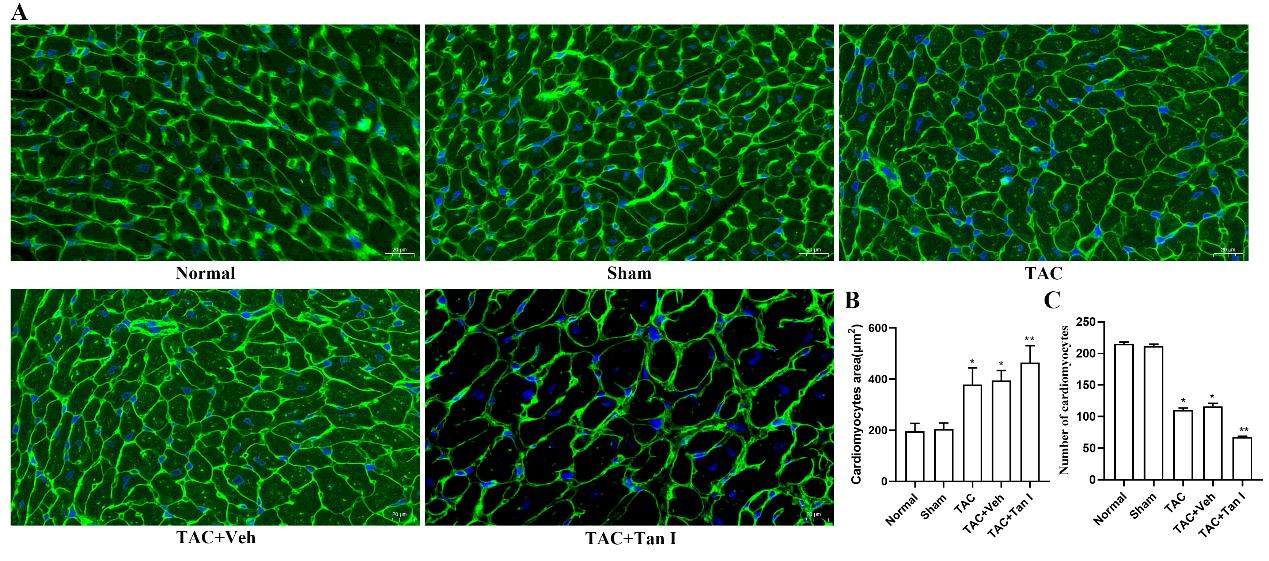
WGA染色观察小鼠心肌细胞面积及数量
WGA染色(图6A)结果表明,TAC术后8周小鼠心肌细胞表面积较假手术组显著增大(P<0.05),而TAC+Tan I组较TAC组心肌细胞表面积亦显著升高 (P<0.05)(图6B)。此外,TAC术后8周小鼠单位面积下心肌细胞数量较假手术组显著减少(P<0.05),而TAC+Tan I组较TAC组单位面积下心肌细胞数量亦显著减少(P<0.05)(图6C)。
讨 论
心力衰竭是一种临床综合征,包括心脏结构改变以及功能异常,是多种心血管疾病的终末阶段。纵观全世界,目前对于慢性心力衰竭依然缺乏较为有效的治疗手段。虽然新的防治措施逐步应用于临床,但仍未得到理想的效果[11-12]。从病理性心肌重构到慢性心力衰竭的发展过程中,通常先经历心肌肥厚再到心脏显著扩大心室壁变薄。其中,心肌肥厚最初被认为是一种适应过程,根据Frank-Starling定律,心室容量增加可增加心输出量,心室壁厚度增加可降低室壁应力,是维持适当的心输出量和血流动力学稳定的重要代偿机制,但心室重构并不能始终维持相对正常的心功能,心肌收缩功能在维持一段时间的平衡后进行性下降,血流动力学紊乱加剧,最终进入终末期心力衰竭[13]。但目前病理性心肌重构的机制并不完全清楚。因此,深入探讨病理性心肌重构的发生发展机制,可能为防治心力衰竭提供新的思路。有研究表明[14-15],组蛋白甲基化酶EZH2缺失可造成左心室发育缺陷,且组蛋白H3K27me3甲基化修饰失衡参与了心肌重构的发生与发展。表明组蛋白甲基化酶EZH2与组蛋白H3K27me3心脏发育及心室重构关系密切。然而EZH2介导的组蛋白H3K27me3甲基化修饰失衡是否参与了压力过载性心肌重构仍不清楚。
压力过载引起的心力衰竭模型,主要是模拟临床上由于高血压、肥胖及心脏血管畸形导致的心室后负荷过重的患者。随着病情的发展,在整个过程中常伴随病理性心肌重构的发生。根据以往文献报道 EZH2 在心脏中的作用[15],我们推测 EZH2 可能在压力过载性心肌重构的发生发展中可能发挥了重要的调控作用。实验结果与我们所设想的一样,TAC 模型组小鼠心肌组织中EZH2呈现低表达,且模型小鼠的心肌组织中组蛋白H3K27me3亦呈现低甲基化,这提示组蛋白H3K27me3甲基化修饰可能受到组蛋白甲基化酶EZH2的调控,与国外相关研究报道一致[16]。Tan I是丹参组成部分之一,有研究显示其对组蛋白甲基化酶EZH2具有抑制作用[17]。本研究显示Tan I处理后的模型小鼠心肌组织中EZH2表达较TAC模型组进一步降低,且组蛋白H3K27me3甲基化水平在Tan I处理后较模型组也是进一步降低。这提示在压力过载性心肌重构中,抑制EZH2的表达可进一步降低组蛋白H3K27me3甲基化水平。
心力衰竭发生机制是多因素共同作用的结果,其中主要因素之一是病理性心肌细胞肥大导致病理性心肌重构[18]。因此,病理性心肌重构是心力衰竭发生发展的必经阶段。β-MHC是心肌重构、心肌肥厚及慢性心力衰竭重要的标志物。从病理性心肌肥厚代偿阶段到慢性心力衰竭的失代偿阶段β-MHC均呈现高表达趋势[19]。在本研究中发现,β-MHC在TAC小鼠心肌组织中亦呈现高表达,且其变化趋势随着组蛋白EZH2表达水平降低而出现高表达,因此,我们推测β-MHC的表达受到EZH2的调控。故我们运用EZH2抑制剂(Tan I)干预TAC小鼠进一步抑制EZH2在小鼠心肌组织中的表达后,发现组蛋白H3K27me3的甲基化水平亦显著降低,更重要的是EZH2抑制剂Tan I处理后可进一步上调β-MHC蛋白表达水平,这也进一步证实EZH2对β-MHC的调控可能是通过影响组蛋白H3K27me3的甲基化修饰,使得β-MHC基因的表达异常进而出现过表达情况,同时也使得心肌重构进一步加重向心力衰竭终末期进展。此外,我们进一步通过心脏彩超检测了TAC术后不同时期小鼠心功能情况。结果显示,随着心肌重构的进展,左心室前壁以及后壁的厚度由最初的增大到后期变薄,小鼠心功能呈现了先代偿增加后衰竭降低的变化。WGA染色也发现心肌细胞面积则是出现了进行性增大的情况,在心功能出现衰竭降低时心肌细胞面积较之前代偿阶段进一步增大。给予EZH2抑制剂Tan I进一步降低EZH2表达水平后,心肌细胞表面积亦进一步增大。这些均提示EZH2介导的H3K27me3甲基化修饰水平可能在压力过载性心肌重构中发挥了重要作用。
综上所述,EZH2介导的组蛋白H3K27m3甲基化修饰失衡可能参与了压力过载性心肌重构的发生发展。调控EZH2表达水平能在一定程度上影响压力过载性心肌重构。这可能为防治病理性心肌重构提供新的治疗靶点。但本研究亦存在不足之处,EZH2在TAC模型中显著降低,本应该选择EZH2激动剂干预模型组,但目前尚无有效的EZH2激动剂上市,本应通过过表达上调EZH2的水平,但由于实验条件及时间有限,本研究均未使用,我们仅仅使用了EZH2抑制剂负向调控TAC小鼠。
Obesity, hypertension, and cardiac dysfunction: novel roles of immunometabolism in macrophage activation and inflammation
[J]. Circ Res, 2020, 126(6): 789-806. https://doi.org/10.1161/CIRCRESAHA.119.312321.Prevalence of heart failure and left ventricular dysfunction in China: the China hypertension survey, 2012-2015
[J]. Eur J Heart Fail, 2019, 21(11): 1329-1337. https://doi.org/10.1002/ejhf.1629.Melanocortin-4 receptors and sympathetic nervous system activation in hypertension
[J]. Curr Hypertens Rep, 2019, 21(6): 46. https://doi.org/10.1007/s11906-019-0951-x.Obesity-induced hypertension: interaction of neurohumoral and renal mechanisms
[J]. Circ Res, 2015, 116(6): 991-1006. https://doi.org/10.1161/CIRCRESAHA.116.305697.The many faces of heart failure
[J]. Card Electrophysiol Clin, 2019, 11(1): 11-20. https://doi.org/10.1016/j.ccep.2018.11.001.Genome-wide DNA methylation encodes cardiac transcriptional reprogramming in human ischemic heart failure
[J]. Lab Invest, 2019, 99(3): 371-386. https://doi.org/10.1038/s41374-018-0104-x.Divergent requirements for EZH1 in heart development versus regeneration
[J]. Circ Res, 2017, 121(2): 106-112. https://doi.org/10.1161/CIRCRESAHA.117.311212.Polycomb repressive complex 2 regulates normal development of the mouse heart
[J]. Circ Res, 2012, 110(3): 406-415. https://doi.org/10.1161/CIRCRESAHA.111.252205.The roles and mechanisms of epigenetic regulation in pathological myocardial remodeling
[J]. Front Cardiovasc Med, 2022, 9: 952949. https://doi.org/10. 3389/fcvm.2022.952949.ERK信号通路介导的EP300过表达在苯肾上腺素诱导小鼠心肌细胞肥大中的作用
[J]. 中国病理生理杂志, 2021, 37(5): 818-824. https://doi.org/10.3969/j.issn.1000-4718.2020.02.002.2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure
[J]. Eur Heart J, 2021, 42(36): 3599-3726. https://doi.org/10.1093/eurheartj/ehab368.Current and future therapeutic perspective in chronic heart failure
[J]. Pharmacol Res, 2022, 175: 106035. https://doi.org/10.1016/j.phrs.2021. 106035.Expression of nucleolin in pressure overload-induced cardiac hypertrophy rats
[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2014, 39(2): 124-128. https:// doi.org/10.11817/j.issn.1672-7347.2014.02.003.Histone modification landscape and the key significance of H3K27me3 in myocardial ischaemia/reperfusion injury
[J]. Sci China Life Sci, 2023, 66(6): 1264-1279. https://doi.org/10.1007/s11427-022-2257-9.EZH2 as an epigenetic regulator of cardiovascular development and diseases
[J]. J Cardiovasc Pharmacol, 2021, 78(2): 192-201. https://doi.org/10.1097/FJC. 0000000000001062.EZH2 controls epicardial cell migration during heart development
[J]. Life Sci Alliance, 2023, 6(6):Tanshinone I, a new EZH2 inhibitor restricts normal and malignant hematopoiesis through upregulation of MMP9 and ABCG2
[J]. Theranostics, 2021, 11(14): 6891-6904. https://doi.org/10.7150/thno.53170.Molecular biomarkers in cardiac hypertrophy
[J]. J Cell Mol Med, 2019, 23(3): 1671-1677. https:// doi.org/10.1111/jcmm.14129.Neuropeptide Y mediates cardiac hypertrophy through microRNA-216b/FoxO4 signaling pathway
[J]. Int J Med Sci, 2021, 18(1): 18-28. https://doi.org/10.7150/ijms.51133.作者声称无任何利益冲突。
马一翔, 彭昌, 吴书琪, 田小春. EZH2介导的组蛋白H3K27me3甲基化修饰失衡在小鼠压力过载性心肌重构中的作用[J]. 中南大学学报(医学版), 2024, 49(9): 1388-1396. DOI:10.11817/j.issn.1672-7347.2024.230335
MA Yixiang, PENG Chang, WU Shuqi, TIAN Xiaochun. Effect of histone H3K27me3 methylation modification imbalance mediated by EZH2 on pressure-overload myocardial remodeling in mice[J]. Journal of Central South University. Medical Science, 2024, 49(9): 1388-1396. DOI:10.11817/j.issn.1672-7347.2024.230335
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024091388.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.230335

