帕金森病是一类神经退行性疾病,在该类疾病中发病率排名第二,且发病率呈现逐年上升趋势[1]。目前,目前全球范围内约有850万人患病,患者主要以60岁以上老年人为主,且女性患者多于男性[2]。帕金森病患者脑黑致密部多巴胺能神经元的死亡导致多巴胺分泌减少,使患者出现肌肉僵硬、运动迟缓、静止性震颤等运动症状,部分患者还会出现情绪障碍、睡眠障碍等非运动症状[3-4]。由于自然条件下多巴胺能神经元死亡后难以补充,药物与手术等治疗方式均无法重建患者受损的神经通路,无法从根本上治愈帕金森病[5]。近年来研究证明,通过定向诱导将易于获得的星形胶质细胞转分化为神经元,可以重建受损的神经通路以治疗帕金森病[6-8]。
星形胶质细胞是神经系统中含量最为丰富的胶质细胞,为脑内神经元提供结构和代谢支持,并调节大脑内的突触传递、水分运输和血流,释放各种营养因子支持神经元的发育,平衡和调节细胞外的谷氨酸,GABA和腺苷在中枢神经系统的基本神经递质水平[9-11]。体外实验证明,星形胶质细胞与神经元共享一种早期的神经祖细胞,这些细胞在一系列基因的调控下可以分化为神经元或星形胶质细胞,说明星形胶质细胞在转分化为神经元上与其他神经细胞相比有一定优势[12],且星形胶质细胞在脑内存量大、可增殖,易于获得。
2010年,Ruiz等证明在体外用逆转录病毒感染星形胶质细胞,过表达转录因子Oct-4、Sox-2、Klf4可将AS重编程为多能干细胞[13]。2017年,Pia Rivetti di等通过慢病毒转染在AS中过表达NEUROD1, ASCL1和LMX1A三个转录因子,得到了接近于内源性人多巴胺能神经元的细胞[14]。ASCL1被证明可以在神经元的分化中发挥作用,在星形胶质细胞中过表达ASCL1可以产生功能性神经元[15]。NURR1是诱导TH表达以及多巴胺能神经元分化的重要因子,在多巴胺能神经元的发育和存活中起着重要作用,且NURR1的过表达可以提高AS的重编程效率,使AS向多巴胺能神经元方向转分化[16-19]。通过病毒携带目的基因转染细胞导入外源基因是使特定基因过表达的常用方法,而慢病毒作为载体具有可以感染原代细胞,并且可以在细胞中长期表达,发挥作用更持久的优势。
因此,本研究通过慢病毒携带转录因子NURR1及ASCL1转染原代大鼠星形胶质细胞,过表达NURR1及ASCL1转录因子,诱导星形胶质细胞转分化为多巴胺能神经元(dopaminergic neurons,DA)并将转分化后的AS-iDA细胞移植入PD模型大鼠的右内侧前脑束区域,检测AS-iDA在大鼠脑内的存活、迁移、分化情况及对PD大鼠运动能力的修复效果,为AS-iDA细胞移植治疗PD的相关研究提供依据。
对象与方法
实验动物
20只约8周龄健康雄性SD大鼠,由安徽医科大学实验动物中心提供,饲养于清洁动物房,室温22~26 ℃,定期更换垫料并清洁、消毒鼠笼及水瓶,饲养密度每笼≤4只,喂食商品化颗粒饲料。实验操作按照我国《实验动物福利伦理审查指南(GB/T 35892-2018)》要求,规范落实实验动物福利伦理。
主要试剂
DMEM高糖培养基(gibco)、L-glutamine、胎牛血清FBS(gibco)、Neurobasal培养基(gibco)、B27(gibco)、BDNF(PeproTech)、GDNF(PeproTech)、AA(BioSharp)、N2(Gemini)、CAMP、GluataMAX(gibco)、0.25%胰蛋白酶(gibco)、多聚赖氨酸(Poly-L-Lysine)(Sigma)、6-羟基多巴胺(6-OHDA)(Sigma)、阿扑吗啡(APO)(Sigma-Aldrich)、青霉素-链霉素(双抗)、4’,6-二脒基-2-苯基吲哚(DAPI)染液(上海碧云天生物科技有限公司)、TritonX-100(Sigma)、兔抗ASCL1(华美生物)、兔抗GFAP(Neuromics)、鼠抗TUJ1(Abcam)、兔抗TH(Abcam)、兔抗NURR1(Bioss)、兔抗S100β(Bioss)、兔抗FOXA2(Bioss)、驴抗兔Cy3(Jackson Lab)、抗荧光淬灭剂(Invitrogen)。
方法
大鼠星形胶质细胞分离与培养
取新生72 h以内乳鼠2~3只,酒精消毒后断头处死,在预冷的PBS溶液中洗去头部残留的血液。在冰板上固定好头部,剥开头皮和颅骨,暴露脑组织,在体视显微镜下用镊子去掉嗅球和小脑,并剥除内外脑膜,将脑组织置于预冷的PBS中,用眼科剪剪成约2 mm小块,在体视显微镜下检查是否还有尚未剥除的脑膜。
将脑组织用PBS清洗三次后转入15 mL离心管中,去掉PBS后加入4 mL 0.25%胰蛋白酶,轻柔吹打10~15次使脑组织悬浮与胰蛋白酶充分接触后置于37 ℃培养箱中消化,每隔5 min取出上下颠倒混匀,共计消化20 min。消化结束后加入4 mL预冷的PBS终止消化,并使用70 μm细胞筛过滤,滤液1 000 rpm离心5 min,可见底部细胞沉淀,去上清液后加入3 mL由10% FBS,1% l-glutamine 和DMEM高糖培养基配置的完全培养基重悬沉淀后的细胞,轻柔吹打混匀后转入提前用多聚赖氨酸包被过的T25培养瓶,使细胞均匀铺满瓶底,置于37 ℃培养箱中培养,每隔3 d换液,约9 d左右铺满瓶底。
大鼠星形胶质细胞鉴定
将P3代大鼠星形胶质细胞接种于多聚赖氨酸包被、铺有无菌爬片的24孔板中用完全培养基培养,待细胞长满后,进行免疫荧光鉴定。弃掉培养基后,加入PBS洗一次,弃PBS后用4%多聚甲醛固定18 min,PBS清洗3次,每次5 min,然后依次加入封闭液1(1×PBS+2%BAS+10% NDS+1% TritonX-100)封闭8 min,弃封闭液1后加入封闭液2(1×PBS+2% BAS+10% NDS)55 min,弃封闭液2后PBS清洗3次,每次5 min。加入一抗GFAP(1꞉300),S100β(1꞉500),TUJ1(1꞉300)于4 ℃放置过夜。次日,弃一抗,PBS清洗3次每次5 min,加入二抗,加入荧光标记的二抗后室温避光孵育1 h,使用的荧光二抗包括Alexa Fluor 488(1꞉500),CY3(1꞉1 000),孵育结束后PBS清洗3次,每次5 min,然后加入DAPI(1꞉1 000)孵育15 min,孵育结束后PBS清洗3次,在一洁净载玻片上滴加抗荧光淬灭剂后将爬片取出,吸干液体,爬片的细胞面与抗荧光淬灭剂接触封片,荧光显微镜(Olympus)观察染色结果,ImageJ软件对所得图片进行分析定量。
慢病毒LV-NURR1-ASCL1的构建
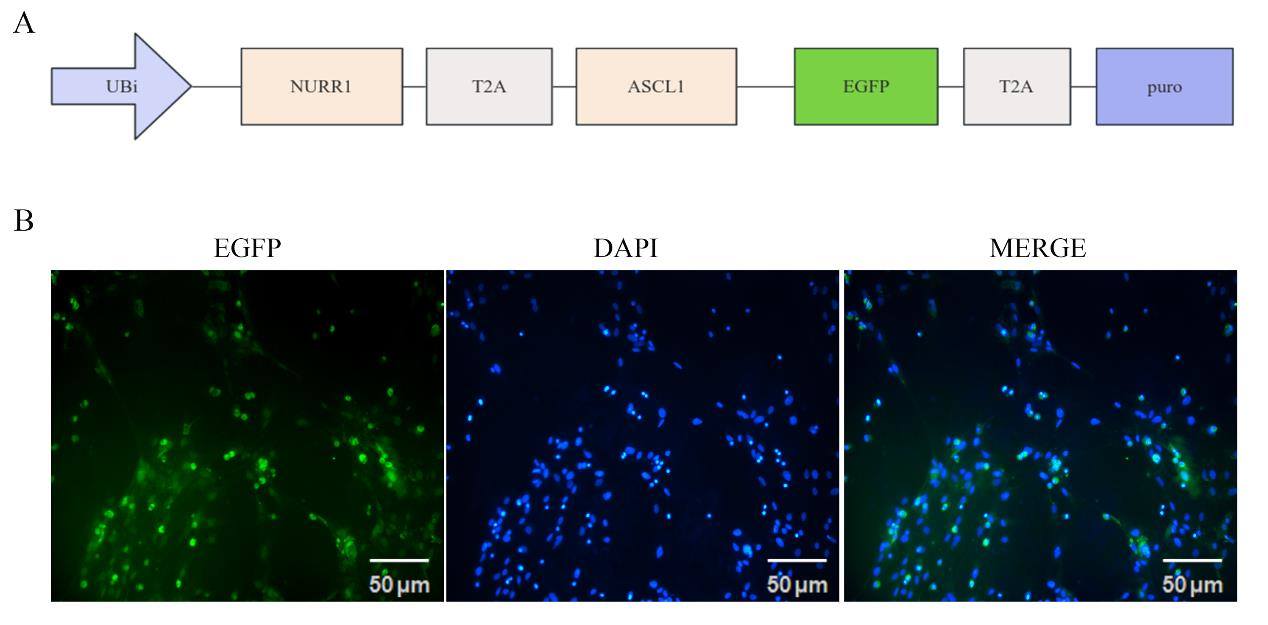
NCBI 数据库搜寻目的基因大鼠NURR1基因(Gene ID: 54278),大鼠ASCL1基因(Gene ID: 64186)的编码序列(coding sequence,CDS),选用慢病毒表达载体GV492,元件顺序Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,将扩增的大鼠NURR1基因和大鼠ASCL1基因插入,构建载体Ubi-MCS-NURR1-T2A-ASCL1-3FLAG-CBh-gcGFP-IRES-puromycin,简写为LV-NURR1-ASCL1。慢病毒的构建、包装与滴度测定由上海吉凯基因医学科技公司完成,病毒滴度为为 1×108 TU/mL。
慢病毒转染星形胶质细胞
细胞计数后按24孔板每孔5×104个细胞将大鼠P3代星形胶质细胞接种于多聚赖氨酸包被后的24孔板中,待细胞汇合度70-80%时,将LV-NURR1-ASCL1加入完全培养基中[感染复数(multiplicity of infection,MOI)꞉3],同时加入4%的助转剂。感染16~24 h后,将含有病毒的培养基弃掉,加入新鲜的完全培养基,约72 h后,荧光显微镜(Olympus)观察病毒携带的荧光蛋白EGFP(绿色)表达情况,判断感染效率。
NURR1、ASCL1在大鼠星形胶质细胞中过表达鉴定
按RIPA꞉PMSF 100꞉1的比例配置细胞裂解液,提取感染3 d后细胞的总蛋白,所得总蛋白经超声裂解后置于冰上裂解30 min,12 000 rpm,4 ℃低温离心30 min去除细胞碎片等杂质,分光光度计测定蛋白浓度后加入五分之一体积的SDS-PAGE蛋白上样缓冲液后煮沸10 min后进行Western Blot检测或-80 ℃冻存。
所得蛋白在10%的SDS-PAGE凝胶中以180 V电压恒压电泳,电泳后将对应位置的凝胶中的蛋白质以340 mA恒流的方式电转至PVDF膜上,Western blot封闭液封闭1 h,加入NURR1(1꞉1 000),ASCL1(1꞉1 000),β-actin(1꞉1 000)一抗,4 ℃过夜。次日使用二抗山羊抗小鼠GAM(1꞉5 000),山羊抗兔GAR(1꞉5 000)孵育1 h,凝胶成像仪中经ECL化学显影液显影得到蛋白表达情况的条带,Image J软件对所得条带进行灰度分析定量。
提取感染3 d后星形胶质细胞总RNA,检测 RNA 样品的纯度与浓度后,使用Prime ScriptTM RT Master Mix 试剂盒(TaKaRa公司)将RNA逆转录成cDNA,并使用基因特异性引物进行PCR扩增,PCR所用引物经NCBI数据库设计,Rat-NURR1-F:ACGATCTCCTGACTGGCTCT,Rat-NURR1-R:GGTCGGTTCAATCCCCCATT,产物大小427bp,Rat-ASCL1-F:TCGTCCTCTCCCGAACTGAT,Rat-ASCL1-R:TGGACTAAGGGGGTCGTAGG,产物大小402 bp。免疫荧光鉴定NURR1和ASCL1在感染后细胞中的过表达情况。
转录因子诱导星形胶质细胞转分化为多巴胺能神经元
慢病毒转染P3代星形胶质细胞3 d后,荧光显微镜观察病毒中携带的绿色荧光蛋EGFP在细胞中的表达情况,将培养基更换为含Neurobasal、B27、BDNF、GDNF、AA、N2、CAMP、GluataMAX的神经元成熟培养基培养,每隔3 d更换一次培养基,约4~6 d后细胞形态出现较为明显变化,部分细胞出现神经元状的长突触,随后每隔3 d更换一次培养基,记录细胞形态变化。21 d后,对诱导后的AS-iDA细胞进行免疫荧光检测TUJ1、FOXA2、TH的表达。
PD大鼠模型建立及细胞移植
取6~8周雄性SD大鼠,体重180~220 g,异氟烷麻醉后固定于大鼠脑立体定位上,根据第六版大鼠脑图谱,选取大鼠脑右侧两个位点注射6-OHDA,位点1:AP-4.4 mm,ML-1.2 mm,DV-7.8 mm,位点2:AP-4.0 mm,ML-0.8 mm,DV-8.0 mm,注射时每个位点注射8 μL 6-OHDA,注射速度为0.5 μL/min。2周后注射APO 诱导PD模型大鼠向健康侧旋转,30 min内旋转圈数超过210圈为成模。将AS-iDA定量(1×105个)后用8 μL Neurobasal培养基重悬,使用立体定位仪注入PD模型大鼠脑内,注射位点、速度与建模时相同。
移植后PD大鼠行为学检测
旷场实验:在旷场箱正中格上方安置摄像头,避光启动旷场实验追踪记录软件后,摄像头会记录大鼠5 min内在旷场箱中的运动情况,包括大鼠在旷场箱中的运动总距离,在中央格中的停留时间等。
疲劳转棒实验:将待测大鼠按组分类后置于匀速旋转的转棒上,记录实验动物在30 min内的在棒时间。
移植后PD大鼠免疫荧光
移植AS-iDA 4周后,用异氟烷麻醉PD大鼠后心脏灌注,随后在冰上快速取出大脑,4%多聚甲醛固定4-6 h后将大脑先后置于25%和30%蔗糖溶液中梯度脱水,脱水后将大脑置于-80 ℃冻存。将鼠脑冰冻切片切为厚度14 μm的脑片,用明胶包被过的载玻片粘附,PBS浸泡后封闭1 h(1×PBS+2%BAS+10% NDS+10%NGS+1% TritonX-100),PBS清洗3次每次3 min后加入一抗TH、TUJ1、FOXA2孵育过夜。弃一抗后PBS洗3次,每次3 min,加入二抗孵育1 h,PBS洗3次每次3min,加入DAPI孵育15 min,孵育后PBS洗3次,每次3 min,在脑片上滴加抗荧光淬灭剂后用盖玻片封片。
统计学处理
采用Graphpad 8.0.1软件进行统计学分析并生成 图表,所得实验数据用均数±标准差表示,组间比较采用t检验,以P<0.05认为差异具有统计学意义。
结 果
大鼠原代星形胶质细胞分离培养及鉴定
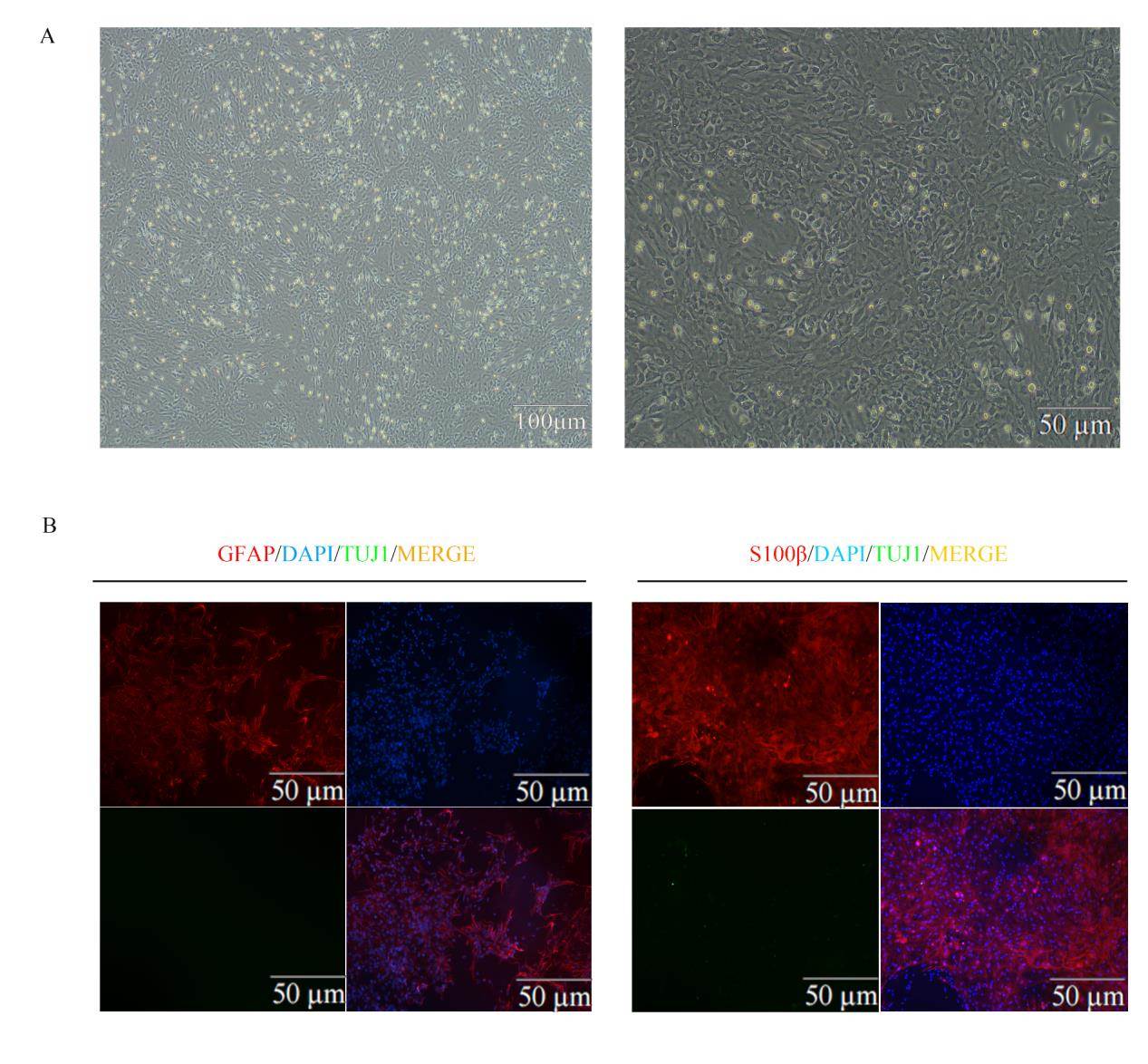
大鼠原代星形胶质细胞在完全培养基中培养传代至P3代,经形态学鉴定P3代大鼠星形胶质细胞呈现典型的星形胶质细胞形态,形态饱满、胞体较大且形状不规则,有较多短且细长突触(图1A)。免疫荧光鉴定显示,P3代星形胶质细胞可表达星形胶质细胞标志物GFAP及S100β(图1B),且不表达神经元标志物TUJ1,表明分离培养的星形胶质细胞中不含神经元。
过表达NURR1及ASCL1基因慢病毒载体LV-NURR1-ASCL1的构建和感染AS后荧光蛋白表达
慢病毒具有能感染原代细胞,且在宿主细胞中长期表达的特性,因此选择慢病毒作为载体。构建的包含转录因子NURR1和ASCL1的慢病毒载体LV-NURR1-ASCL1如图2A所示,用自剪多肽T2A分隔NURR1和ASCL1,载体中携带EGFP荧光蛋白基因用于检测感染效率。LV-NURR1-ASCL1转染P3代大鼠星形胶质细胞3 d后,通过病毒中携带的荧光蛋白EGFP检测病毒转染效率约为95%(图2B)。慢病毒LV-NURR1-ASCL1可以高效转染大鼠原代AS,并持续发挥作用。
过表达LV-NURR1-ASCL1 慢病毒感染AS后目的基因表达
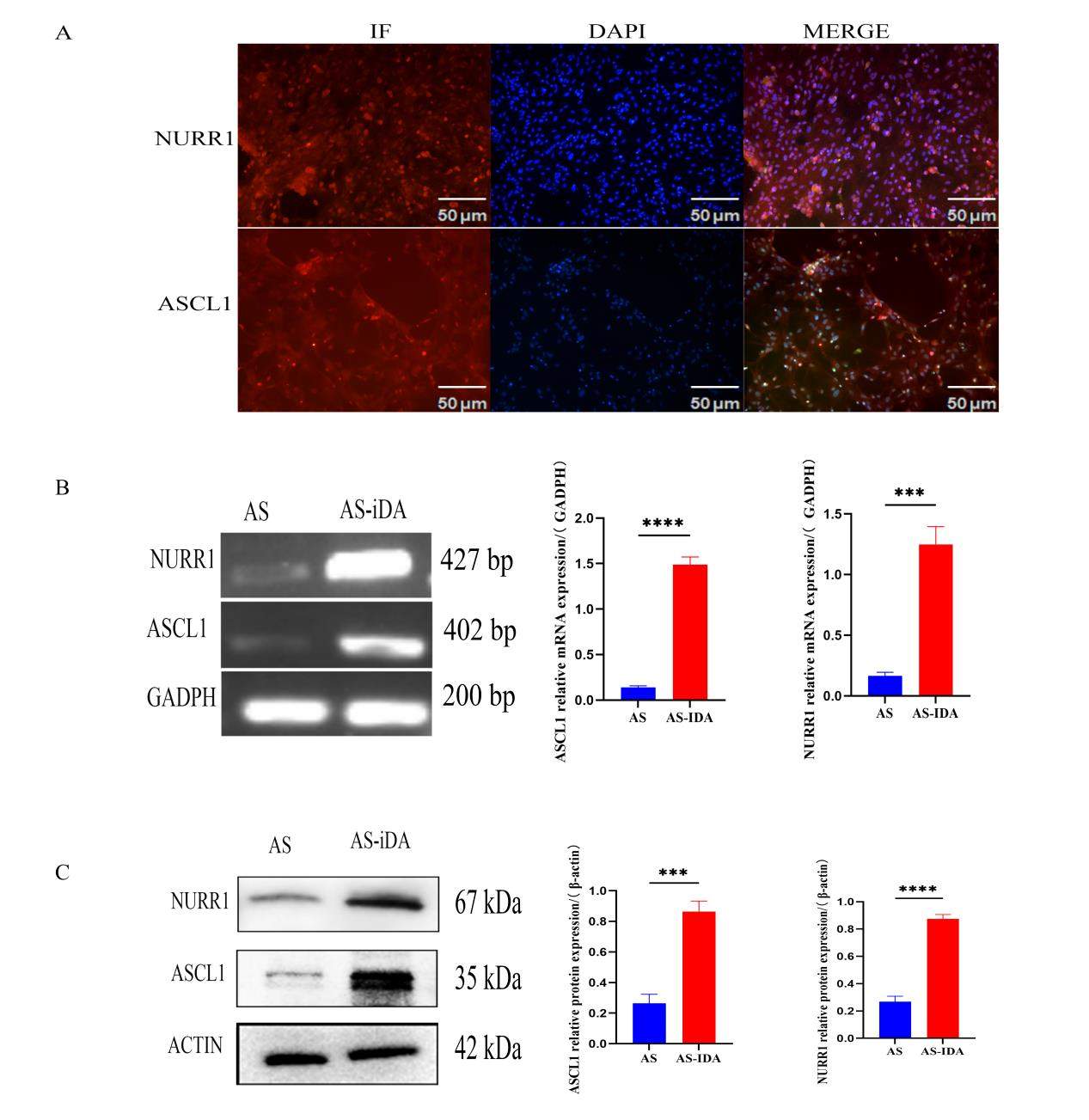
免疫荧光、RT-PCR、Western blot检测结果表明慢病毒转染AS后能稳定表达NURR1及ASCL1。免疫荧光结果显示慢病毒转染后的AS可见NURR1及ASCL1的表达(图3A)。RT-PCR结果显示,慢病毒转染后感染组相较于对照组NURR1和ASCL1的mRNA表达量分别上升了(7.483±0.7055)倍和(10.830±1.94)倍(图3B),Western blot结果显示感染组NURR1和ASCL1的蛋白表达量分别上升了(2.403±0.5105)倍和(4.423±0.6030)倍(图3C),以上三者证明慢病毒LV-NURR1-ASCL1转染AS后能在AS中发挥作用,提高NURR1和ASCL1的表达量,符合预期结果。
过表达LV-NURR1-ASCL1诱导AS为AS-iDA及免疫荧光鉴定
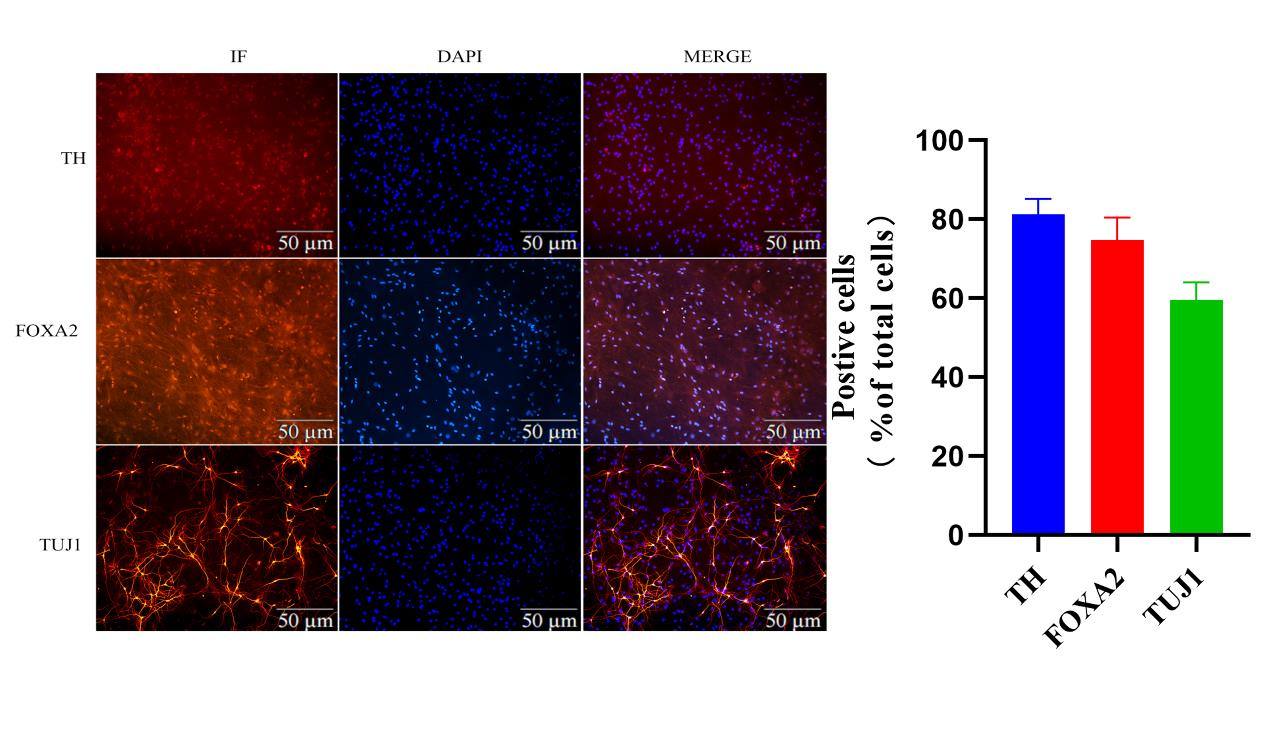
慢病毒转染P3代大鼠AS 4 d时,将培养基更换为神经元成熟培养基继续培养,可见细胞形态随时间推移发生明显改变,越来越多的细胞出现神经元样的长突触,至18d时细胞呈现明显的神经元样细胞形态(图4A、B)。21 d时对AS-iDA进行免疫荧光检测,AS-iDA表达多巴胺能神经元的表面标志物TH和FOXA2,表达神经元的表面标志物TUJ1(图5),表明此时AS-iDA已转分化为多巴胺能神经元,通过细胞计数,比例约在68.6%。

AS-iDA移植PD大鼠
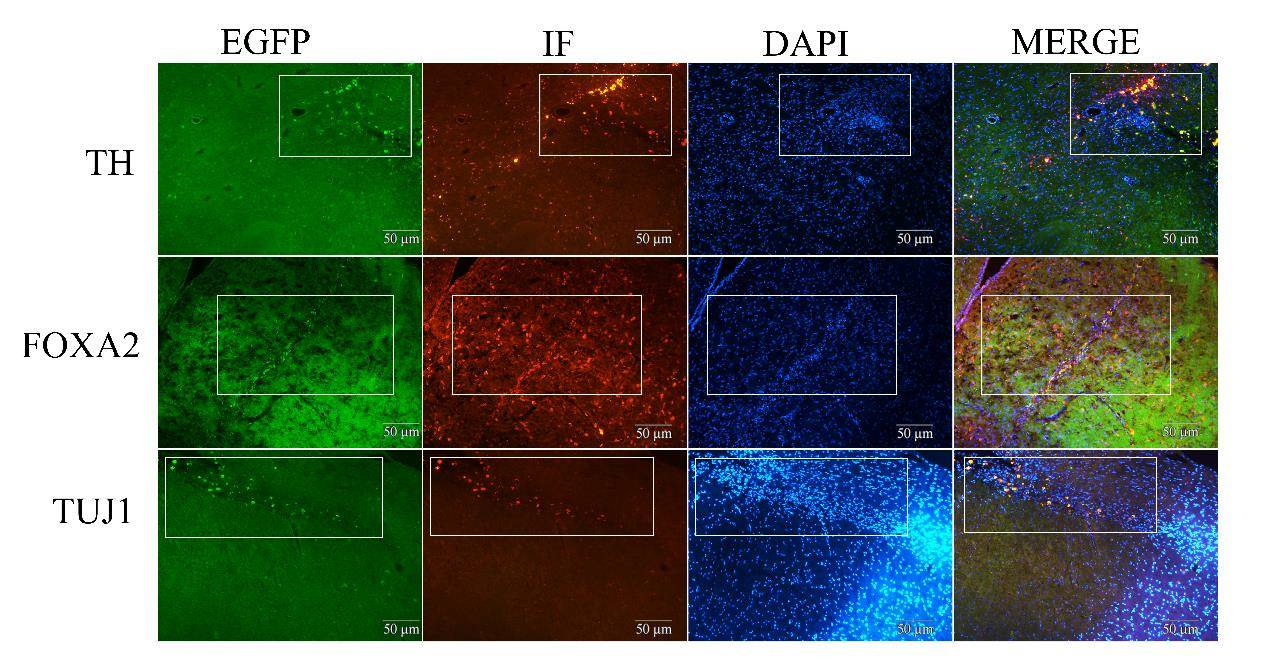
建模2周后进行APO诱导旋转实验,30 min内旋转次数大于210次为成模,将成模的PD大鼠分为AS-iDA移植组和模型组,AS-iDA定量(1×105)后定向移植入AS-iDA移植组大鼠脑MFB区域(图7A)。取移植后4周的AS-iDA组大鼠,麻醉后心脏灌注取脑,冷冻切片后进行免疫荧光化学染色。通过细胞中自带的EGFP绿色荧光蛋白可见AS-iDA在脑内存活,形成明显的移植区域并向周围迁移,其中部分细胞发生远距离迁移。免疫组化染色显示,移植后的AS-iDA表达多巴胺能神经元标志物TH、FOXA2及神经元标志物TUJ1(图6)。以上结果表明移植入PD大鼠脑内的AS-iDA可以在脑内存活并向四周迁移,发挥多巴胺能神经元的功能,修复PD大鼠的损伤。
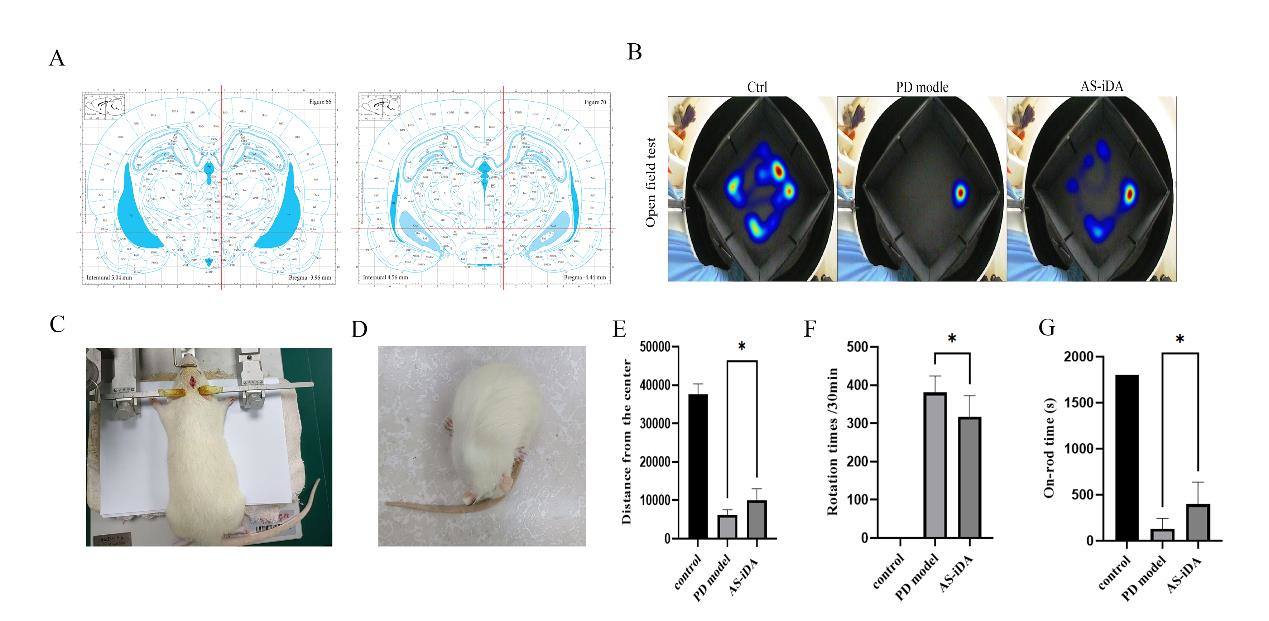
AS-iDA对修复PD模型大鼠运动障碍
AS-iDA移植8周后,模型组、AS-iDA移植组大鼠行为学检测结果显示AS-iDA移植组大鼠在旷场实验、APO诱导旋转实验、转棒实验中相较于对照组大鼠运动能力有显著性恢复(P<0.05,图7B、E、F、G)。旷场实验中,AS-iDA组大鼠距中心移动距离为(9963.04±3048) cm,而对照组为(5867±951.6) cm。AS-iDA移植组大鼠由APO诱导的旋转圈数为316.7±56.14,对照组为380.5±43.46。转棒实验中,AS-iDA移植组和对照组的在棒时间分别为(398.3±240.0) s和(128.7±116.0) s。以上结果表明,AS-iDA移植组PD大鼠的自主运动能力、运动协调能力相对于对照组有明显改善。
讨 论
帕金森病的细胞疗法正日渐成为研究热点,由于神经元细胞的不可再生,常规手段如药物,手术等方式无法根治,只能缓解症状[5, 20]。星形胶质细胞在中枢神经系统中大量存在且有增殖能力,且与神经元细胞有着共同的神经祖细胞,这些神经祖细胞可能进入任何一种状态,因此相较于其他细胞,星形胶质细胞向神经元的转化更具可行性。通过将星形胶质细胞转分化为多巴胺能神经元重建受损的神经通路,恢复多巴胺的分泌是一种前景广阔的帕金森病疗法。
通过慢病毒携带特定外源基因转染受体是细胞是诱导细胞转分化的常用方法,慢病毒携带的基因组可整合到宿主基因组,使宿主细胞长时间稳定表达外源基因。NURR1是一种孤核受体,在酪氨酸羟化酶、泡状单胺转运体和多巴胺活性转运体中发挥作用,是促进中脑多巴胺能神经元发育和维持的重要基因之一,同时也是PD的病理相关靶点之一,有研究表明NURR1可能参与抑制神经炎症来缓解PD症状[21-23]。ASCL1是一种前神经因子,已知可诱导多种细胞类型转化为神经元细胞,在此前的研究中,ASCL1被报道过可以将人的诱导多能干细胞(hIPS),小鼠的胚胎成纤维细胞和星形胶质细胞重编程为功能性神经元[24-25]。
本研究通过慢病毒携带NURR1与ASCL1基因感染大鼠星形胶质细胞,使两种基因在大鼠星形胶质细胞中过表达,诱导星形胶质细胞转分化为多巴胺能神经元。经鉴定慢病毒感染效率可达95%以上,并且病毒转染后可以检测到NURR1和ASCL1蛋白的表达量相比于转染前有明显上升。将病毒转染染后的细胞置于添加了B27,N2,BNDF,GDNF等神经营养因子的培养基中培养后可见细胞形态发生明显变化,出现神经元形态的长突触,在神经元成熟培养基中培养15 d后对细胞进行免疫荧光鉴定,表明AS-iDA可以表达神经元标志物TUJ1以及多巴胺能神经元标志物TH和FOXA2。
AS-iDA移植入PD模型大鼠的MFB区4周时,通过慢病毒自带EGFP荧光蛋白观察到AS-iDA在大鼠脑MFB区域存活并向周边区域迁移,免疫组化染色后,可见移植入脑内的AS-iDA表达多巴胺能神经元标志物TH、FOXA2以及神经元标志物TUJ1。移植后第8周,AS-iDA移植组大鼠APO诱导旋转次数相较于对照组出现显著性的下降(P<0.05),在转棒实验和旷场实验中相对于对照组PD大鼠,细胞移植组大鼠的运动能力也有明显改善(P<0.05)。
AS-iDA移植后可以在体内表达TH以及FOXA2与TUJ1,其中TH是一种将L-酪氨酸转化为 L-3,4-二羟苯丙氨酸(L-DOPA)的酶,L-DOPA是多巴胺的前体,可以被DDC催化为DA,它的存在对多巴胺的合成和分泌起着重要作用,而FOXA2则是指导多巴胺能神经元特异性分化和转录激活的因子,TUJ1则存在于神经元的突触以及胞体末端,并在胶质细胞中不表达,AS-iDA表达TUJ1表明AS-iDA已经转分化为一类神经元样细胞。TH、FOXA2和TUJ1共同表达,表明AS-iDA呈现多巴胺能神经元的特征。因此,AS-iDA移植后可以促进DA的分泌,改善PD大鼠脑内DA缺失这一情况,修复被破坏的神经通路。
在过往的研究中,通过慢病毒原位诱导小鼠星形胶质细胞转分化为多巴胺能神经元的可行性已被证实,但将其与帕金森病的治疗相关联的研究尚少。通过慢病毒注射原位诱导星形胶质细胞转分化难以控制病毒在脑内的转染范围,可能侵染其他神经细胞,且星形胶质细胞在脑内承担多项生理功能,原位诱导会导致大量星形胶质细胞丢失,在神经系统抗炎和维持稳态等方面不利于帕金森病的恢复。
由于多巴胺能神经元在脑内存量较少,直接移植会面临供体细胞短缺的问题,因此,本研究选择在脑内存量大,可增值的星形胶质细胞作为细胞移植的供体,移植后的AS-iDA可见在脑内的迁移与整合,且存活率良好。
综上所述,本研究通过慢病毒携带转录因子NURR1与ASCL1高效转染星形胶质细胞,诱导其转分化为多巴胺能神经元,并检测到相关标志物TUJ1、TH和FOXA2的表达。将AS-iDA移植入PD模型大鼠脑内MFB区域4周后可见细胞在脑内的存活与迁移并表达TUJ1、TH和FOXA2。移植8周时,通过APO诱导旋转、旷场实验、转棒实验证明AS-iDA对PD大鼠的运动障碍有显著修复效果,为AS-iDA细胞的工程化培养及细胞重编程治疗帕金森病提供依据。
Parkinson’s disease and Parkinsonism
[J]. Am J Med, 2019, 132(7): 802-807. https://doi.org/10.1016/j.amjmed. 2019.03.001.The pathogenesis of Parkinson’s disease
[J]. Lancet, 2024, 403(10423): 293-304. https://doi.org/10.1016/S0140-6736(23)01478-2.The clinical symptoms of Parkinson’s disease
[J]. J Neurochem, 2016, 139(Gut mucosal cells transfer α-synuclein to the vagus nerve
[J]. bioRxiv, 2023: 2023.08.14.553305. https://doi.org/10.1101/2023.08.14.553305.Parkinson’s disease and Parkinsonism
[J]. Am J Med, 2019, 132(7): 802-807. https://doi.org/10.1016/j.amjmed. 2019.03.001.Reversing a model of Parkinson’s disease with in situ converted nigral neurons
[J]. Nature, 2020, 582(7813): 550-556. https://doi.org/10.1038/s41586-020-2388-4.Stem cell-based therapies for parkinson disease
[J]. Int J Mol Sci, 2020, 21(21): 8060. https://doi.org/10.3390/ijms21218060.Human stem cell-derived neurons repair circuits and restore neural function
[J]. Cell Stem Cell, 2021, 28(1): 112-126.e6. https://doi.org/10.1016/j.stem. 2020.08.014.Astrocyte involvement in blood-brain barrier function: a critical update highlighting novel, complex, neurovascular interactions
[J]. Int J Mol Sci, 2023, 24(24): 17146. https://doi.org/10.3390/ijms242417146.Human astrocytes in the diseased brain
[J]. Brain Res Bull, 2018, 136: 139-156. https://doi.org/10.1016/j.brainresbull.2017.02.001.Astrocytes as secretory cells of the central nervous system: idiosyncrasies of vesicular secretion
[J]. EMBO J, 2016, 35(3): 239-257. https://doi.org/10.15252/embj.201592705.Longitudinal scRNA-seq analysis in mouse and human informs optimization of rapid mouse astrocyte differentiation protocols
[J]. Nat Neurosci, 2023, 26(10): 1726-1738. https://doi.org/10.1038/s41593-023-01424-2.High-efficient generation of induced pluripotent stem cells from human astrocytes
[J]. PLoS One, 2010, 5(12):Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson’s disease model
[J]. Nat Biotechnol, 2017, 35(5): 444-452. https://doi.org/10.1038/nbt.3835.Molecular mechanisms underlying Ascl1-mediated astrocyte-to-neuron conversion
[J]. Stem Cell Reports, 2021, 16(3): 534-547. https://doi.org/10. 1016/j.stemcr.2021.01.006.Advances in NURR1-regulated neuroinflammation associated with Parkinson’s disease
[J]. Int J Mol Sci, 2022, 23(24): 16184. https://doi.org/10.3390/ijms232416184.The role of astrocyte dysfunction in Parkinson’s disease pathogenesis
[J]. Trends Neurosci, 2017, 40(6): 358-370. https://doi.org/10.1016/j.tins. 2017.04.001.Efficient generation of dopaminergic neurons from mouse ventral midbrain astrocytes
[J]. Biomol Ther, 2023, 31(3): 264-275. https://doi.org/10.4062/biomolther.2022.140.Neuronal trans-differentiation by transcription factors Ascl1 and Nurr1: induction of a dopaminergic neurotransmitter phenotype in cortical GABAergic neurons
[J]. Mol Neurobiol, 2020, 57(1): 249-260. https://doi.org/10.1007/s12035-019-01701-x.Astrocyte-to-neuron reprogramming and crosstalk in the treatment of Parkinson’s disease
[J]. Neurobiol Dis, 2023, 184: 106224. https://doi.org/10.1016/j.nbd.2023.106224.Nurr1-based therapies for Parkinson’s disease
[J]. CNS Neurosci Ther, 2016, 22(5): 351-359. https://doi.org/10.1111/cns.12536.Nurr1 promotes neurogenesis of dopaminergic neuron and represses inflammatory factors in the transwell coculture system of neural stem cells and microglia
[J]. CNS Neurosci Ther, 2018, 24(9): 790-800. https://doi.org/10.1111/cns.12825.Nurr1 protein is required for N-methyl-D-aspartic acid (NMDA) receptor-mediated neuronal survival
[J]. J Biol Chem, 2012, 287(14): 11351-11362. https://doi.org/10.1074/jbc.M111.272427.Transdifferentiating astrocytes into neurons using ASCL1 functionalized with a novel intracellular protein delivery technology
[J]. Front Bioeng Biotechnol, 2018, 6: 173. https://doi.org/10.3389/fbioe.2018. 00173.Efficient generation of dopaminergic neurons from mouse ventral midbrain astrocytes
[J]. Biomol Ther, 2023, 31(3): 264-275. https://doi.org/10.4062/biomolther.2022.140.作者声称无任何利益冲突。
刘淳博, 应梦娇, 王澳, 刘宇萌, 陈颖, 叶文豪, 文河保, 马彩云, 刘长青, 郭俣. 星形胶质细胞重编程多巴胺神经元对帕金森病模型大鼠运动功能障碍的修复效应[J]. 中南大学学报(医学版), 2024, 49(9): 1377-1387. DOI:10.11817/j.issn.1672-7347.2024.240078
LIU Chunbo, YING Mengjiao, WANG Ao, LIU Yumeng, CHEN Ying, YE Wenhao, WEN Hebao, MA Caiyun, LIU Changqing, GUO Yu. Repair effect of astrocyte reprogramming dopamine neurons on motor dysfunction in Parkinson disease model rats[J]. Journal of Central South University. Medical Science, 2024, 49(9): 1377-1387. DOI:10.11817/j.issn.1672-7347.2024.240078
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024091377.pdf
http://dx.chinadoi.cn/

