椎间盘退变(intervertebral disc degeneration,IDD)是多种脊柱退行性疾病发生的病理基础,也是诱发慢性下腰痛的常见原因[1]。IDD的患病率随着年龄的增长而急剧增加,在50岁以上人群中,IDD患者超过90%[2],但目前的治疗策略为控制症状并最大限度地减轻患者痛苦,无法从根源上逆转IDD进程,远期疗效较为有限[3]。因此,揭示IDD的分子机制对相关疾病的预防、治疗和后期康复具有重要意义。锌指蛋白(zinc finger protein,ZNF)是一类在基因转录调控中具有重要作用的转录因子,该家族的多个成员已被发现参与IDD进展。为此,本研究通过分析公共数据库中IDD相关基因数据,选取其中与疾病进展相关的ZNF667作为目标基因,并通过IDD患者的临床组织样本验证其表达,IDD细胞模型观察其对髓核细胞炎症和凋亡的影响,从分子水平揭示ZNF667在IDD髓核细胞炎症损伤中的作用机制,以期为临床治疗IDD提供参考。
材料与方法
材料
临床组织样本
收集2021年7月至2022年6月益阳市中心医院脊柱外科收治的3例IDD患者(IDD组)和3例外伤导致椎体骨折患者(Control组)的髓核组织,其中IDD组患者均经磁共振和病理检查确诊,并排除类风湿性关节炎和强直性脊柱炎,Control组为单纯椎体骨折患者。
主要试剂与仪器
人原代髓核细胞购自武汉普诺赛生命科技有限公司;杜氏改良Eagle培养基(Dulbecco’s Modified Eagle’s Medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶均购自美国Gibco公司;兔抗ZNF667、髓分化因子88(myeloid differentiation factor 88,MyD88)、磷酸化P65(phosphorylation-P65,p-P65)、P65、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体均购自美国Abcam公司;实时聚合酶链反应相关试剂,白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及环氧化酶-2(cyclooxygenase-2,COX-2)的免疫酶联免疫吸附实验(enzyme-linked immuno sorbent assay,ELISA)检测试剂盒均购自武汉默沙克生物科技有限公司;TRIzol试剂盒、苏木精-伊红(hematoxylin and eosin,HE)染色试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白质浓度测定试剂盒、放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解液均购自上海碧云天生物技术股份有限公司;莫洛尼鼠白血病病毒(Moloney murine leukemia virus,M-MLV)逆转录酶试剂盒和Lipofactamine 2000细胞转染试剂盒均购自美国赛默飞世尔科技公司;异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)-膜联蛋白V(Annexin V)试剂盒购均购自美国Becton Dickinson公司。
方法
本研究已获益阳市中心医院伦理委员会批准(审批号:2020-015)和研究对象的知情同意。
筛选差异表达基因
选取基因表达综合 (gene expression omnibus,GEO)数据库中2个IDD相关基因数据集GSE124272(包括8例IDD患者和8例健康对照者的样本)、GSE150408(包括17例未经过治疗的IDD患者和17例健康对照者的样本),利用R语言包及limma工具包对2个数据集进行分析,经过交叉筛选得到差异表达基因(differential expression gene,DEG)[log2|差异倍数(fold change,FC)|>0.60,P<0.05]。分析DEG中与基因调控转录密切相关的ZNF家族成员,确定目标基因。通过IDD相关数据集(GSE124272、GSE150408、GSE56081、GSE147383、GSE23130),分析目标基因的表达情况。
HE染色
将IDD组和Control组髓核组织置于多聚甲醛溶液中进行固定后,进一步行脱水、石蜡包埋、切片等处理;先用苏木精染色,再用伊红进行复染;用中性树胶封盖切片,在光学显微镜下观察髓核组织。
免疫组织化学技术
将石蜡切片脱蜡、水化,使用抗原修复液进行冷修复;向切片滴加过氧化物酶阻断剂,以阻断内源性过氧化物酶的活性;用磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤后,滴加抗ZNF667抗体,于4 ℃孵育过夜;用PBS洗涤后,滴加反应增强液,于室温温育10 min;滴加二抗(1꞉200)后于室温温育30 min。用PBS洗涤后滴加2滴显色剂,将显色剂冲洗干净以终止显色后,用苏木精复染,PBS返蓝,乙醇脱水,二甲苯透明化,干性树脂封固;在镜下观察ZNF667的表达情况,阳性染色为黄棕色。
基因功能富集分析
采用Pearson相关性分析对GSE56081和GSE147383数据集中与ZNF667相关的基因进行筛选,并通过基因集富集分析(gene set enrichment analysis,GSEA)对筛选出的基因进行功能富集分析。
细胞培养及处理
将人原代髓核细胞接种到培养皿并置于细胞培养箱(5% CO2、37 ℃)中培养,每2~3 d更换1次培养基,每天观察细胞生长及贴壁情况,细胞生长至80%~90%融合时进行传代。实验用细胞为第3代细胞。使用10 ng/mL白细胞介素-1β(interleukin-1β,IL-1β)处理细胞(IL-1β组)构建IDD细胞模型,另设对照(Control)组,细胞不作任何处理。
细胞转染
通过转染ZNF667过表达质粒至髓核细胞实现 ZNF667的过表达(IL-1β+oe-ZNF667)组。根据Gene数据库中的ZNF667基因碱基序列信息,设计相应引物(表1),并委托生工生物工程(上海)股份有限公司合成。经过反转录、目的基因扩增、双酶切、连接,将ZNF667基因片段嵌入空载体pcDNA3.1质粒。使用空载体pcDNA3.1质粒作为对照(IL-1β+oe-NC组),按照Lipofactamine 2000细胞转染试剂盒说明书步骤进行细胞转染。
| 基因 | 引物序列(5'-3') |
|---|---|
| GAPDH | F: ACAGCCTCAAGATCATCAGC |
| R: GGTCATGAGTCCTTCCACGAT | |
| ZNF667 | F: AATCAATGCAACAAATCTGGGC |
| R: CACTCTTTCGTGTAGGAGCTTTT |
流式细胞术检测细胞凋亡
采用Annexin V标记和流式细胞仪检测细胞凋亡。收集3×105个细胞,用PBS冲洗,并按照FITC-Annexin V试剂盒说明书的步骤进行染色标记。用流式细胞仪对标记后的细胞进行分析。
ELISA检测细胞炎症因子表达
取细胞培养液500 μL,以6 000 r/min冷冻离心5~10 min后,取上清液。使用ELISA试剂盒检测上清液中COX-2、IL-6、TNF-α的含量。按照试剂盒说明书,用包被缓冲液稀释酶标抗体,酶标抗体与待测样本在室温下温育1 h后,加入亲和素过氧化物酶复合物在温室下温育1 h,再加入终止液。测定 450 nm处吸光度值,绘制标准曲线,根据标准曲线查出待测样品中相关细胞炎症因子的含量。
实时聚合酶链反应
采用TRIzol法提取组织总RNA,微量核酸测定仪检测总RNA的纯度、浓度。按照M-MLV逆转录酶试剂盒说明书将总RNA反转录为cDNA,参照实时聚合酶链反应扩增试剂盒说明书配制反应体系,进行扩增反应。GAPDH为内对照,使用2-ΔΔCt法计算ZNF667 mRNA的表达水平。
蛋白质印迹法检测ZNF667、MyD88、p-P65表达
应用RIPA裂解液裂解细胞,提取细胞蛋白质,测定蛋白质浓度。取30 μg样品上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,初始以80 V恒压电泳40 min,后提升电压至120 V,电泳80 min;将蛋白质条带从凝胶转移至硝酸纤维素膜,随后将膜放入封闭液中,室温下摇晃1 h;分别加入抗ZNF667抗体(稀释比1꞉10 000)、抗MyD88抗体(稀释比1꞉10 000)、抗p-P65抗体(稀释比1꞉1 000)、抗P65抗体(稀释比 1꞉1 000)[内对照为GAPDH(抗体稀释比为1꞉2 500)],在4 ℃下孵育过夜;洗膜后加入二抗(稀释比1꞉5 000),在室温下摇晃温育1 h,清洗后滴加发光液显影,使用ImageJ软件检测蛋白质条带的灰度,分析蛋白质的相对表达量。
统计学处理
使用GraphPad Prism 7软件进行统计学分析,数据以均数±标准差表示,采用t检验进行2组间的比较,P<0.05为差异有统计学意义。
结 果
IDD中的DEG
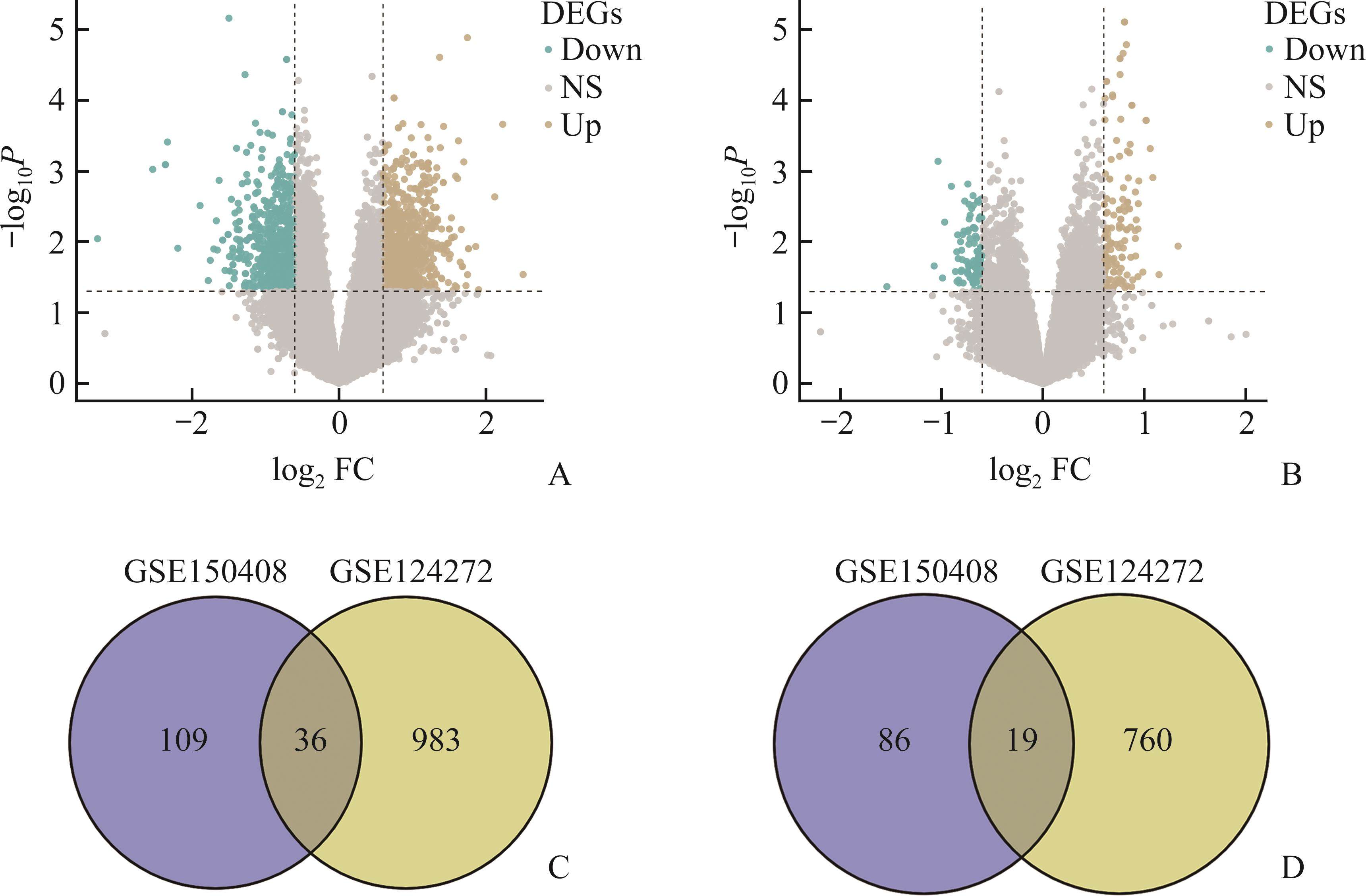
GSE124272中存在1 019个上调基因,779个下调基因;GSE150408中存在145个上调基因,105个下调基因(均log2|FC|>0.80,P<0.05;图1A、1B);经过交叉分析获得36个共同上调的DEG,19个共同下调的DEG(图1C、1D)。
ZNF667在IDD患者髓核组织中低表达
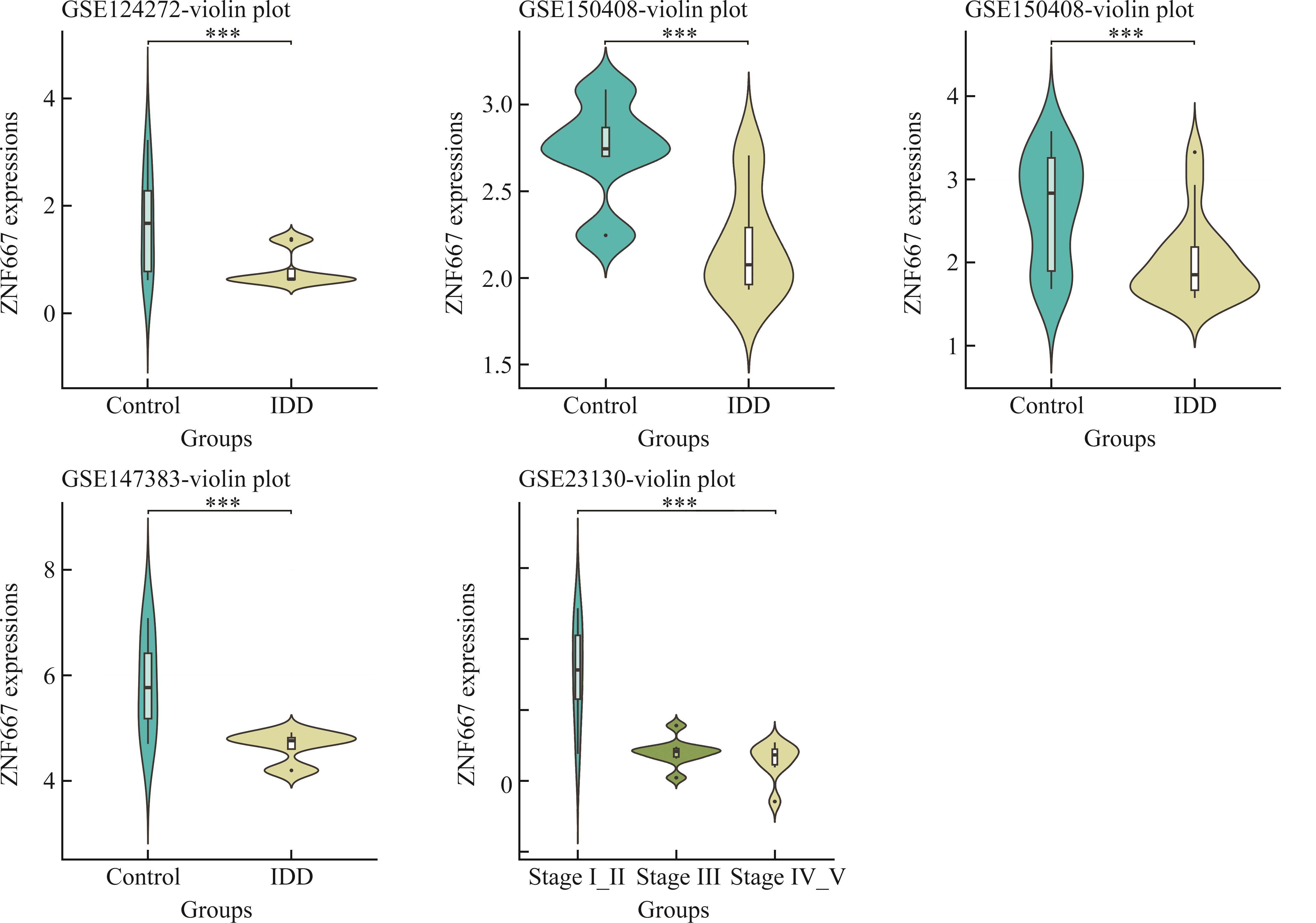
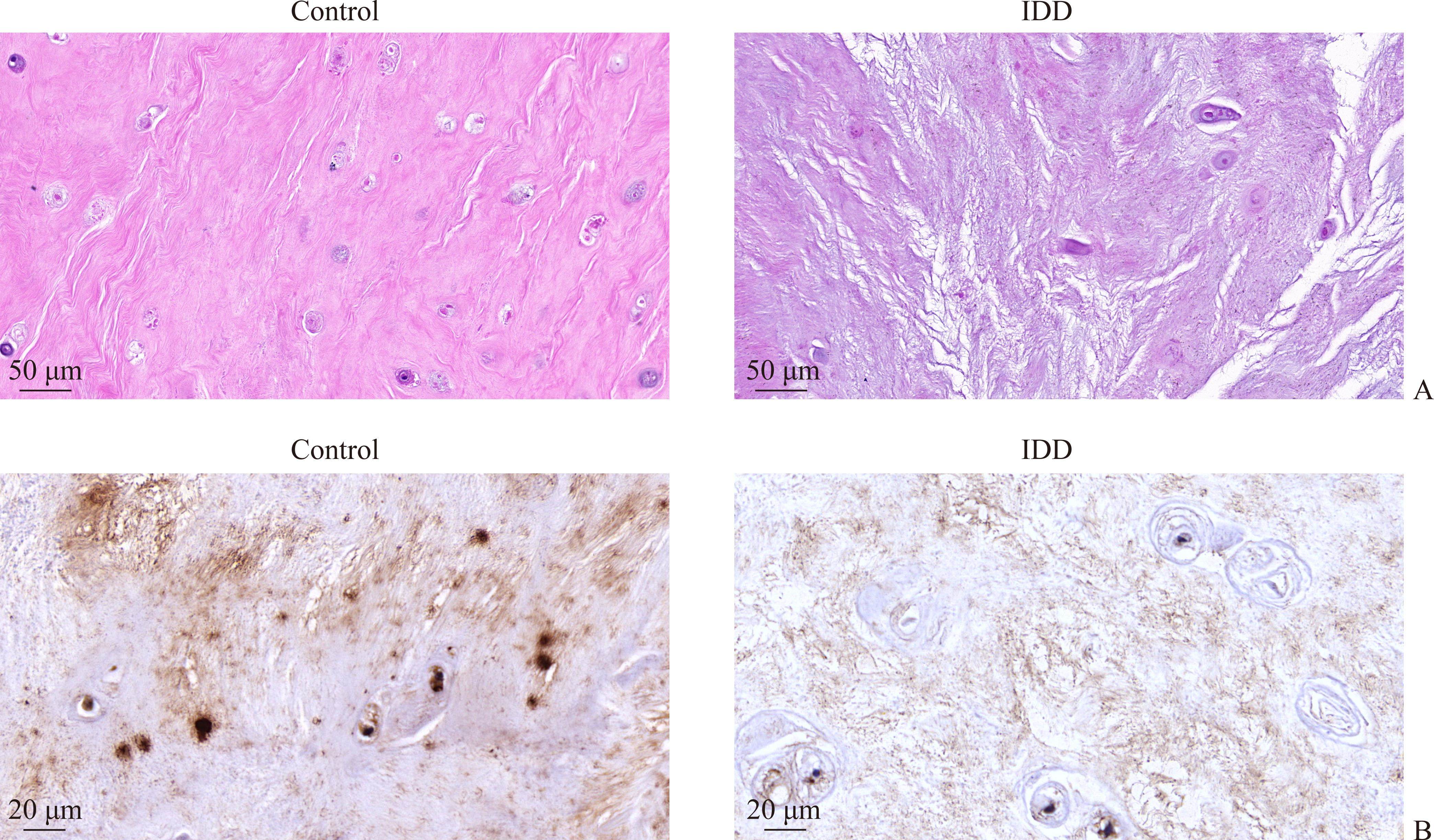
上述DEG中包括多个与基因转录调控密切相关的ZNF家族成员,如ZNF157、ZNF439和ZNF667,其中ZNF667在IDD中的作用还鲜有报道。对IDD相关数据集进行分析的结果显示:在GSE124272、GSE150408、GSE56081和GSE147383中,相较于人正常髓核组织,ZNF667在退变髓核组织中低表达(图2A-2D,均P<0.001);在GSE23130中,随着椎间盘病变的加重,ZNF667的表达上调(图2E)。HE染色结果显示:Control组椎间盘组织形态完整,髓核与纤维环间界限清晰,存在丰富的细胞外基质和大量髓核细胞,而IDD组髓核组织细胞外基质和髓核细胞明显减少,纤维软骨细胞排列紊乱(图3A)。IHC结果显示:IDD组髓核组织ZNF667的表达(黄棕色)明显低于Control组(图3B)。
ZNF667的GSEA结果
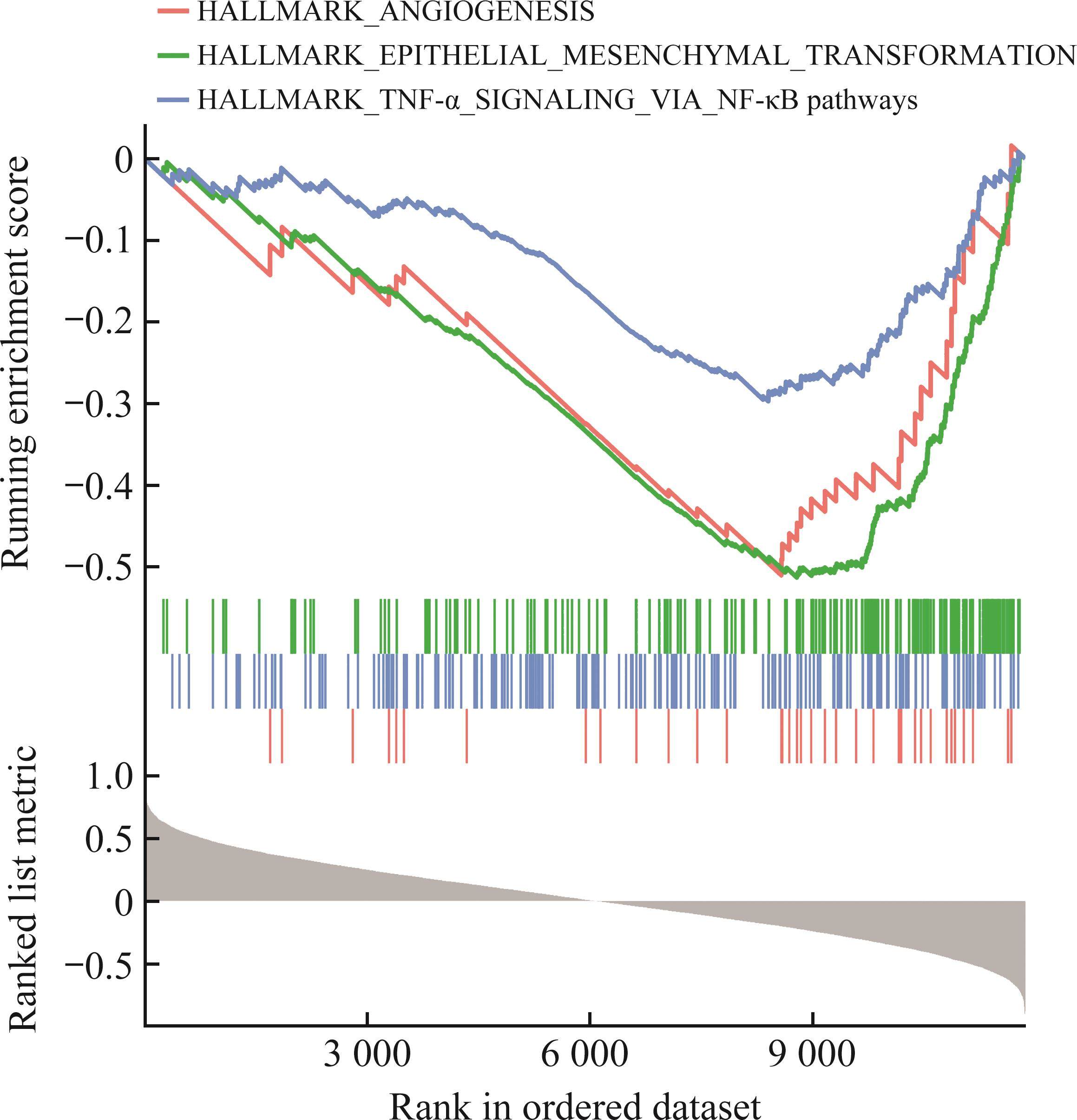
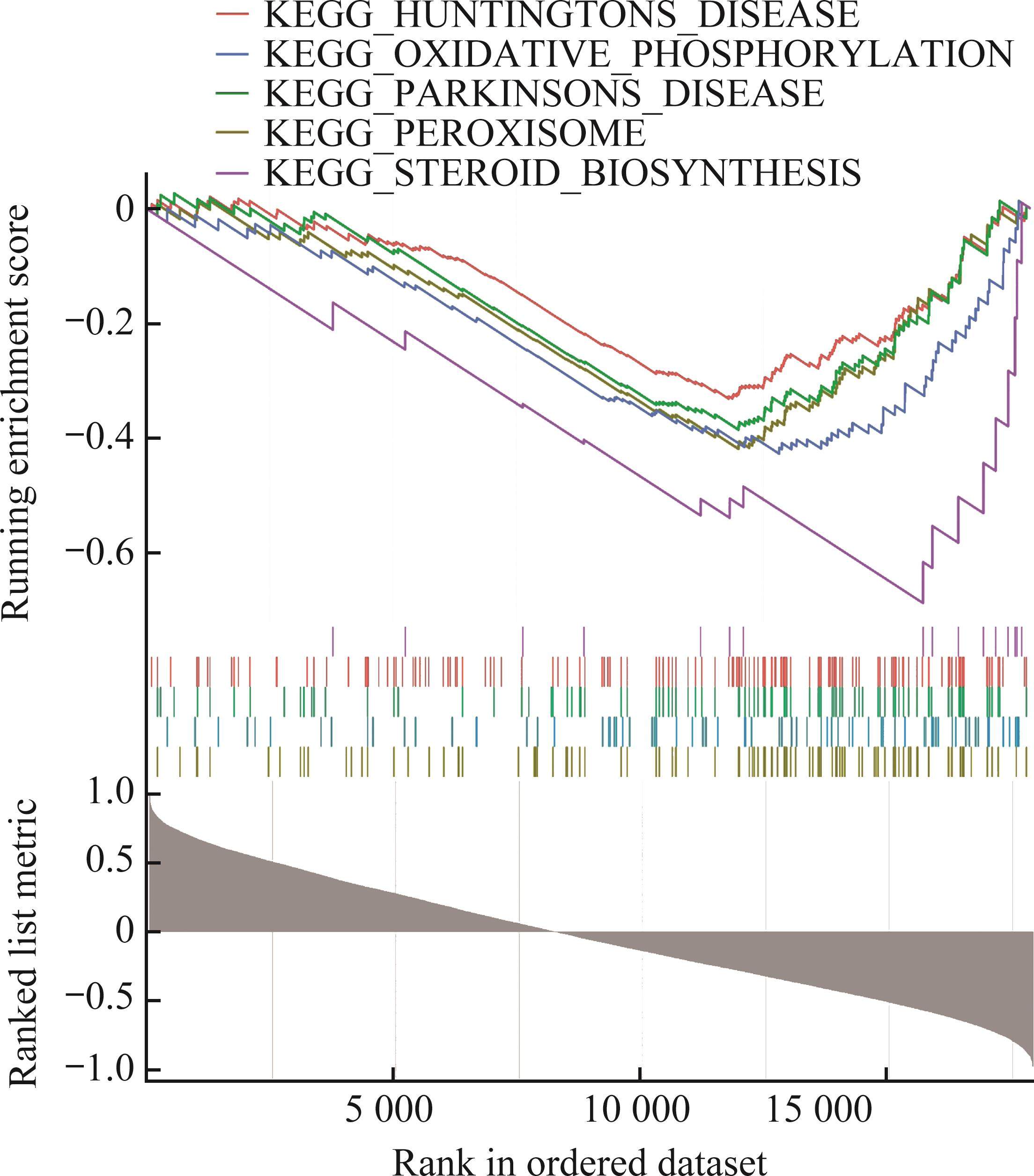
Pearson相关性分析结果显示:在GSE56081中,有640个基因与ZNF667的表达呈显著正相关,660个基因与ZNF667的表达呈显著负相关;在GSE147383中,有1 465个基因与ZNF667的表达呈显著正相关,960个基因与ZNF667的表达呈显著负相关。GSEA结果显示:GSE56081中的相关基因在血管新生、上皮间质转化(epithelial-mesenchymal transition,EMT)转化、核因子κB(nuclear factor-κB,NF-κB)介导的TNF-α信号通路等方面显著富集(图4);GSE147383中的相关基因在氧化磷酸化、过氧化物酶体、类固醇生物合成等通路中显著富集(图5)。
IDD细胞模型中ZNF667低表达且NF-κB通路过度活化
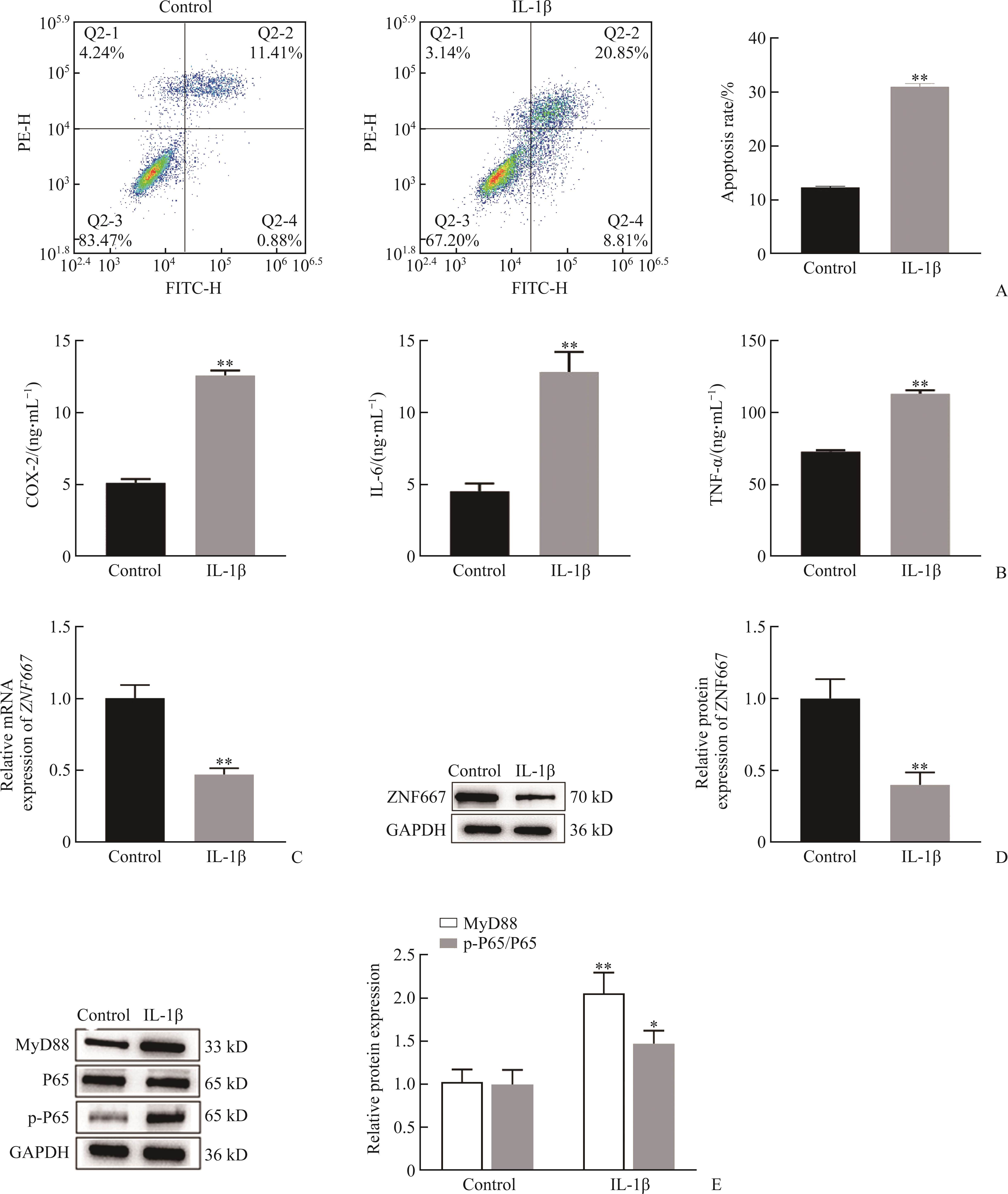
流式细胞术和ELISA检测结果显示:与Control组相比,IL-1β组髓核细胞的凋亡率显著增加(t=56.210,P<0.01;图6A),炎症因子COX-2(t=30.510,P<0.01)、IL-6(t=9.658,P<0.01)、TNF-α(t=22.290, P<0.01)的表达水平均显著上调(图6B)。这表明IDD细胞模型构建成功。实时聚合酶链反应和蛋白质印迹法结果显示:与Control组比较,IL-1β组ZNF667的mRNA表达水平(t=9.177,P<0.01)和蛋白质表达水平(t=7.482,P<0.01)均显著下调(图6C、6D)。同时,蛋白质印迹法结果显示:IL-1β组NF-κB信号通路相关因子中MyD88(t=7.168,P<0.01)、p-P65/P65(t=9.226,P<0.05)表达水平均较Control组显著上调(图6E)。这提示IL-1β诱导的IDD细胞模型中ZNF667的表达显著下降,而NF-κB通路则被过度激活。
ZNF667过表达逆转IDD细胞模型中凋亡水平、炎症反应及NF-κB信号通路的激活
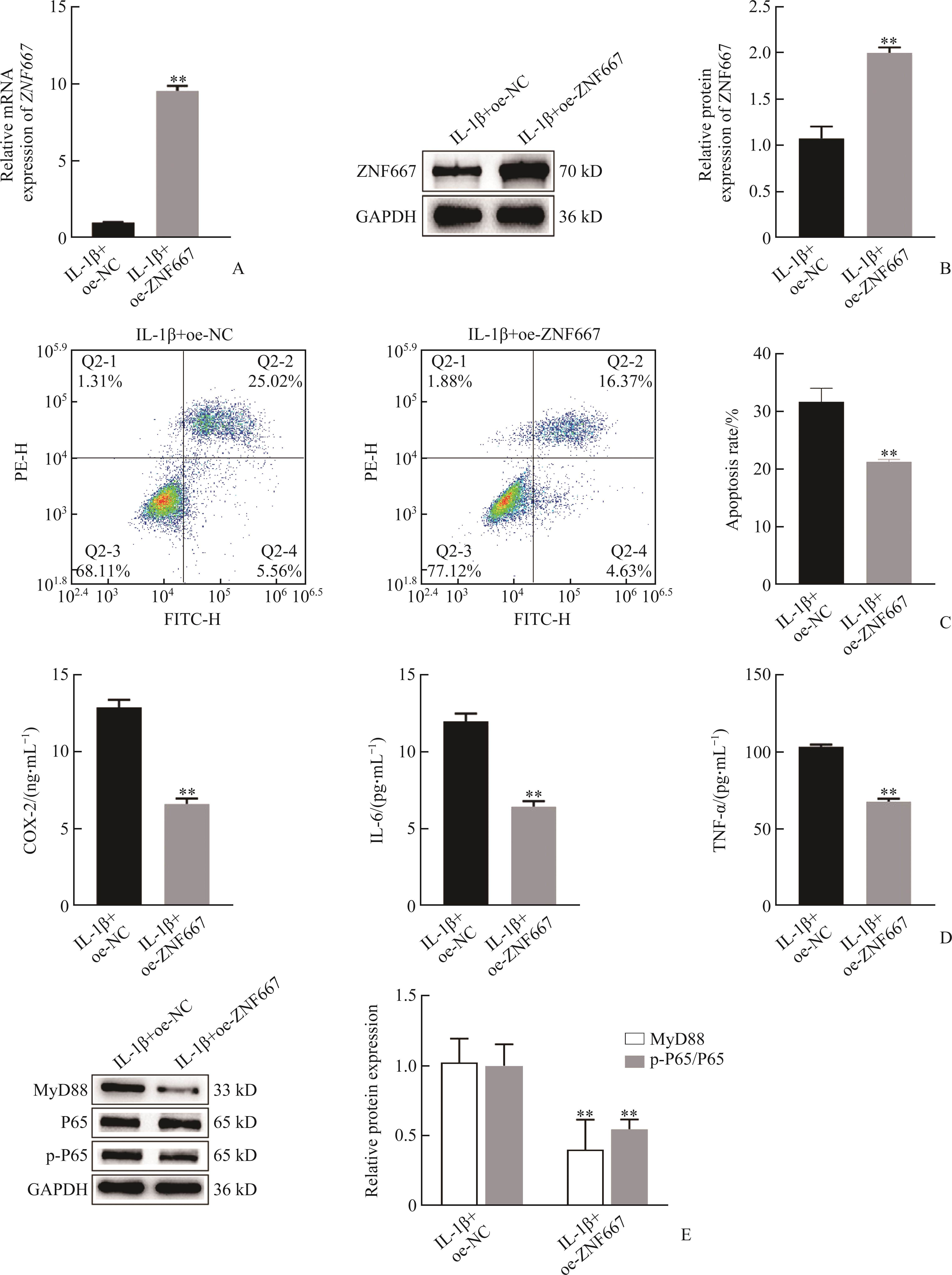
实时聚合酶链反应和蛋白质印迹法结果显示:与IL-1β+oe-NC组相比,IL-1β+oe-ZNF667组ZNF667的mRNA(t=45.910,P<0.01)和蛋白质(t=13.040,P<0.01)表达水平均显著上调(图7A、7B)。流式细胞术和ELISA结果显示:与IL-1β+oe-NC组相比,IL-1β+ oe-ZNF667组细胞凋亡率显著下降(t=7.755,P<0.01),炎症因子COX-2(t=18.050,P<0.01)、IL-6(t=15.590,P<0.01)、TNF-α(t=26.440,P<0.01)的表达水平均显著下调(图7C、7D)。蛋白质印迹法结果显示:与IL-1β+oe-NC组相比,IL-1β+oe-ZNF667组NF-κB信号通路相关因子中MyD88(t=4.555,P<0.01)、p-P65/P65(t=8.593,P<0.01)表达水平均显著下调(图7E)。这提示,ZNF667可通过抑制NF-κB通路,降低炎症因子水平,从而延缓IDD进展。
讨 论
IDD是临床常见的退行性疾病,易引起腰痛、椎间盘突出等疾病,是导致患者劳动力和生活能力丧失,严重影响患者生活质量的重要公共健康问题。然而,当前对于早期或存在手术禁忌证的IDD相关脊柱疾病患者缺乏疗效确切的非手术治疗方法,即便可接受手术治疗,患者亦存在较大的并发症风险[1]。因此,揭示IDD发病的分子机制并在此基础上开发针对IDD相关脊柱疾病的非手术治疗方法迫在眉睫。
锌指蛋白因具有结合Zn2+的结构域,并可经由α螺旋和β折叠形成手指样结构而得名[4]。ZNF家族的多个成员已被发现参与IDD进展,如ZNF598在IDD中表达上调,并可通过调控核因子红细胞2相关因子2(nuclear factor erythroid-derived 2-related factor 2,Nrf2)泛素化降解,促进软骨终板损伤和IDD进展[5]。髓核中表达上调的ZNF A20则可通过诱导细胞自噬改善炎症和IDD进展[6]。在干细胞生物工程的研究[7]中,携带AntagomiR-4450的胎盘间充质干细胞衍生外泌体可通过靶向髓核细胞中的ZNF121缓解髓核细胞的炎症和凋亡,改善动物模型的IDD症状。而在本研究发现的多个差异表达的锌指蛋白中,ZNF667的异常表达情况最为普遍。ZNF667由位于人染色体19q13.43上的基因翻译而来,在人体的大多数组织中广泛表达,主要定位于细胞核,可能参与基因转录调控和RNA聚合酶II翻译过程[8]。在IDD患者的临床组织样本和IL-1β诱导的髓核细胞炎症损伤模型中,ZNF667的低表达,这可能是IDD的特征。
本研究通过GSEA发现ZNF667可能参与血管新生、EMT转化及NF-κB介导的TNF-α信号通路。NF-κB信号通路是IDD过程中的一个关键信号通路,已被证明与IDD的进展密切相关[9]。Fang等[10]在脂多糖诱导的IDD大鼠模型中观察到高迁移率族蛋白 B1(high mobility group box-1 protein,HMGB1)作为促炎性细胞因子,可通过激活NF-κB信号通路促进IDD患者髓核细胞中炎症细胞因子的释放;Zhao等[11]研究发现抑制HMGB1/Myd88/NF-κB通路可以降低TNF-α、IL-1β、IL-6等多种炎症因子的表达,改善髓核细胞损伤;Gong等[12]发现麦芽糖醇通过抑制磷酸肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKT)/NF-κB通路和调节核苷酸结合结构域富含亮氨酸重复序列和含热蛋白结构域受体3(nucleotide-binding domain leucine-rich repeat and pyrin domain-containing receptor 3,NLRP3)炎症小体介导的焦亡来改善IDD;研究[13]发现槲皮素通过调节衰老相关分泌表型因子,进而抑制Nrf2/NF-κB信号通路以改善IDD。在本研究中,IL-1β刺激的髓核细胞的凋亡水平和炎症因子水平显著上调,且IL-1β会激活NF-κB通路,同时该过程伴随着ZNF667的显著下调。而ZNF667过表达则可显著逆转IL-1β诱导的NF-κB通路激活、髓核细胞凋亡和炎症因子分泌,与前期研究[14]在脂多糖(lipopolysaccharide,LPS)诱导巨噬细胞炎症模型中发现ZNF667过表达可显著降低TNF-α、IL-6、TNF-α等炎症因子的表达相一致。
在本研究结果中,ZNF667过表达可通过抑制炎症因子介导的NF-κB信号通路的激活来发挥作用,然而目前关于ZNF667是否通过其他机制抑制NF-κB信号通路的激活还未有文献报道。NF-κB抑制剂发挥抑制作用主要是通过2种方式,一种是阻断其下游基因或上游刺激物,正如本实验中证明ZNF667可以抑制NF-κB的炎症诱导因子IL-1β,还有一种是阻断NF-κB抑制因子α(inhibitor of NF-κB-α,IκBα)的降解或者直接作用于IκB激酶α(IκB kinase α,IKKα)和IκB激酶β(IκB kinase β,IKKβ)来维持IκBα的稳定性,如阿司匹林和水杨酸钠通过阻断IκBα的降解来抑制NF-κB[15-16],但ZNF667过表达是否可以通过维持IκBα的稳定性来抑制NF-κB通路的激活,还需要后续实验证实。
综上,本研究结果显示ZNF667在IDD进展中低表达,该因子过表达可抑制NF-κB信号通路,从而改善髓核细胞炎症损伤。因此,ZNF667对IDD有一定的保护作用,有望成为治疗IDD新靶标。
Treatment of intervertebral disc degeneration
[J]. Orthop Surg, 2022, 14(7): 1271-1280. https://doi.org/10.1111/os.13254.Stem cells and exosomes: New therapies for intervertebral disc degeneration
[J]. Cells, 2021, 10(9): 2241. https://doi.org/10.3390/cells10092241.Osteoarthritis year in review 2019: epidemiology and therapy
[J]. Osteoarthritis Cartilage, 2020, 28(3): 242-248. https://doi.org/10.1016/j.joca.2020.01.002.Caught with one’s zinc fingers in the genome integrity cookie jar
[J]. Trends Genet, 2018, 34(4): 313-325. https://doi.org/10.1016/j.tig.2017.12.011.Activation of Nrf2 signaling by 4-octyl itaconate attenuates the cartilaginous endplate degeneration by inhibiting E3 ubiquitin ligase ZNF598
[J]. Osteoarthr Cartil, 2023, 31(2): 213-227. https://doi.org/10. 1016/j.joca.2022.10.008.A20 regulates inflammation through autophagy mediated by NF-κB pathway in human nucleus pulposus cells and ameliorates disc degeneration in vivo
[J]. Biochem Biophys Res Commun, 2021, 549: 179-186. https://doi.org/10.1016/j.bbrc.2021.02.115.Exosomes derived from human placental mesenchymal stromal cells carrying antagomiR-4450 alleviate intervertebral disc degeneration through upregulation of ZNF121
[J]. Stem Cells Dev, 2020, 29(16): 1038-1058. https://doi.org/10.1089/scd.2020.0083.Automated generation of gene summaries at the Alliance of Genome Resources
[J]. Database, 2020, 2020:Targeting NF-κB pathway for the therapy of diseases: mechanism and clinical study
[J]. Signal Transduct Target Ther, 2020, 5(1): 209. https://doi.org/10. 1038/s41392-020-00312-6.IL-1β/HMGB1 signalling promotes the inflammatory cytokines release via TLR signalling in human intervertebral disc cells
[J/OL]. Biosci Rep, 2016, 36(5): e00379[Magnoflorine alleviates “M1” polarized macrophage-induced intervertebral disc degeneration through repressing the HMGB1/Myd88/NF-κB pathway and NLRP3 inflammasome
[J]. Front Pharmacol, 2021, 12: 701087. https://doi.org/10.3389/fphar.2021.701087.Maltol ameliorates intervertebral disc degeneration through inhibiting PI3K/AKT/NF-κB pathway and regulating NLRP3 inflammasome-mediated pyroptosis
[J]. Inflammopharmacology, 2023, 31(1): 369-384. https://doi.org/10. 1007/s10787-022-01098-5.Senolytic agent Quercetin ameliorates intervertebral disc degeneration via the Nrf2/NF-κB axis
[J]. Osteoarthritis Cartilage, 2021, 29(3): 413-422. https://doi.org/10.1016/j.joca.2020.11.006.ZNF667 suppressed LPS-induced macrophages inflammation through mTOR-dependent aerobic glycolysis regulation
[J]. Curr Pharm Des, 2023, 29(17): 1361-1369. https://doi.org/10.2174/1381612829666230530143129.Aspirin attenuates hyperoxia-induced acute respiratory distress syndrome (ARDS) by suppressing pulmonary inflammation via the NF-κB signaling pathway
[J]. Front Pharmacol, 2022, 12: 793107. https://doi.org/10. 3389/fphar.2021.793107.Sodium salicylate inhibits expression of COX-2 through suppression of ERK and subsequent NF-KappaB activation in rat ventricular cardiomyocytes
[J]. Arch Pharm Res, 2003, 26(7): 545-553. https://doi.org/10. 1007/BF02976879.作者声称无任何利益冲突。
钟华, 郭乐斌, 杨焱, 田琛俊, 刘富生, 郑博文. ZNF667通过抑制NF-κB信号通路改善椎间盘退变炎症损伤[J]. 中南大学学报(医学版), 2024, 49(10): 1611-1621. DOI:10.11817/j.issn.1672-7347.2024.240122
ZHONG Hua, GUO Lebin, YANG Yan, TIAN Chenjun, LIU Fusheng, ZHENG Bowen. ZNF667 alleviates the inflammatory damage in intervertebral disc degeneration via inhibiting NF-κB signaling pathway[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1611-1621. DOI:10.11817/j.issn.1672-7347.2024.240122
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101611.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.240122

