随着抗生素不合理使用的增加,表皮葡萄球菌的耐药性逐年增加。此外,表皮葡萄球菌还能黏附于医疗器械表面而形成高耐药性的生物被膜,给临床诊疗带来极大的困难。表皮葡萄球菌属于革兰氏阳性条件致病菌,可在皮肤或呼吸道表面定植,正常状态下是一种能分泌路登素等保护皮肤组织的正常细菌。然而,当患者免疫力低下,或随着侵入性操作进入人体时,可引起相应的感染性疾病,凝固酶阴性表皮葡萄球菌入血后还可引起菌血症[1]。常见的感染类型包括导尿管相关感染、人工心脏瓣膜相关感染和人工关节相关感染等。因此,针对表皮葡萄球菌及其生物被膜的新型药物研发已迫在眉睫[2]。
抗菌药物的研发速度远不及微生物的耐药突变速度,药物重新利用已成为新型抗菌药物的研究热点。Kim等[3]通过高通量筛选实验,发现视黄醇类抗肿瘤药物CD437对金黄色葡萄球菌具有显著的体外和体内杀菌作用。此外,CD437还能有效降低金黄色葡萄球菌持留菌数量,具有重要的临床价值。Zhang等[4]发现高血压治疗药物非洛地平能有效清除小鼠关节植入钛针上形成的生物被膜,其与庆大霉素联用还具有显著的协同抗菌作用。由于已上市药物具有成熟的合成路线、较为明确的毒理学和药代动力学数据,极大地加快了新药的上市,并有效降低了研发成本。
前期研究[5]中,利用葡萄球菌属细菌对1 806种美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市药物进行了抗菌活性筛选,发现81种非抗生素药物具有潜在的可重复的抗葡萄球菌属活性,如治疗特发性血小板减少性紫癜药物艾曲波帕能通过破坏细菌的质子动力势能而发挥抗金黄色葡萄球菌活性,同时还发现匹维溴铵(pinaverium bromide,PVB)对葡萄球菌属细菌中的表皮葡萄球菌具有明显的抗菌活性[5]。PVB是一种用于治疗肠易激综合征的L型钙离子通道阻断剂[6]。虽然,Mao等[7]报道PVB对金黄色葡萄球菌具有抗菌活性,但尚未见其与抗生素联用的抗菌效果及对表皮葡萄球菌的抗菌作用和机制的相关报道。前期本实验室已对小分子药物进行了高通量初筛,发现PVB联用传统抗生素苯唑西林(oxacillin,OXA)对表皮葡萄球菌具有一定的协同抑菌活性。因此,本研究通过微量肉汤稀释实验、棋盘稀释实验、生物被膜清除实验和时间-杀菌曲线等方法系统地检测PVB与OXA的联合抗菌效果,并进一步通过透射电镜、活性氧(reactive oxygen species,ROS)测定和三磷酸腺苷(adenosine triphosphate,ATP)定量等方法揭示PVB的作用机制。
材料与方法
主要仪器与试剂
2’,7’-二氯荧光素二乙酸酯(H2DCFDA)荧光探针、PVB、OXA、二甲基亚砜(dimethyl sulfoxide,DMSO)和结晶紫染液均购自美国MedChemExpress公司。Mueller-Hinton(MH)肉汤和胰蛋白胨大豆肉汤(tryptone soy broth,TSB)购自北京索莱宝科技有限公司。ATP增强型试剂盒购自上海碧云天生物技术有限公司。羊血琼脂平板购自郑州安图生物科技有限公司。96孔细胞培养板和50 mL离心管购自美国康宁公司。全自动麦氏比浊仪购自法国梅里埃公司。恒温摇床、恒温培养箱和-80 ℃低温冰箱购自美国赛默飞公司。Bio-tek全自动酶标仪购自美国伯乐公司。透射电镜购自日本日立公司。激光共聚焦显微镜购自德国蔡司公司。
方法
菌株收集及保存
表皮葡萄球菌标准菌株RP62A购自美国标准菌株收藏中心。表皮葡萄球菌临床菌株SEP101、SEP102、SEP103、SEP104、SEP105、SEP106、SEP107和SEP108均于2022年1至9月收集自中南大学湘雅三医院检验科住院患者的血液标本。细菌经羊血琼脂平板分纯培养,并通过基质辅助激光解析电离-飞行时间质谱进行鉴定。所有菌株均于甘油磁珠中接种,-80 ℃保存,在羊血琼脂平板上传代2次后进行后续实验。
微量肉汤稀释实验
挑取羊血琼脂平板上的新鲜菌落于无菌生理盐水中,用麦氏比浊仪调至0.5麦氏浊度(McFarland,McF),再用MH肉汤按1꞉100稀释后备用。向96孔板中每孔分别加入50 μL用MH肉汤进行倍比稀释至0.031 3~32.000 0 μg/mL PVB和/或OXA,再分别加入50 μL备用菌悬液。DMSO设为阴性对照。将96孔板放置于湿盒中,于37 ℃恒温孵育箱中静置培养16~18 h。读取最低抑菌浓度(minimal inhibitory concentration,MIC),即抑制细菌增殖的最低抗菌药物浓度[8]。
棋盘稀释实验
挑取新鲜菌落于TSB中,于37 ℃下以180 r/min摇菌培养2~4 h至对数生长期,并用麦氏比浊仪调至0.5 McF,用MH肉汤按1꞉100稀释后备用。用新鲜MH肉汤将PVB倍比稀释至0.25~16.00 μg/mL,用备用菌悬液将OXA倍比稀释至0.031 3~2.000 0 μg/mL,向96孔板中每孔分别加入50 μL稀释后的PVB和/或OXA。将96孔板轻轻混匀后置于湿盒中,在37 ℃恒温孵育箱中静置培养16~18 h。根据浊度读取联用后的MIC值或用酶标仪检测630 nm处的吸光度(absorbance,A),并计算协同抑菌指数(fractional inhibitory concentration index,FICI),公式为FICI=(MICA联用B/MICA单用)+(MICA联用B/MICB单用)。FICI≤0.5即为协同作用,0.5<FICI≤4即为无关作用,FICI>4即为拮抗作用[9]。
时间-杀菌曲线
将对数生长期的表皮葡萄球菌RP62A用麦氏比浊仪调至0.5 McF,并用MH肉汤按1꞉100进行稀释,于50 mL离心管中每管加入10 mL。再向各管中分别加入亚抑菌浓度的PVB、OXA和PVB+OXA,使PVB和OXA的终浓度分别为1/4×MIC。将离心管放置于37 ℃恒温摇床上以180 r/min摇菌培养,并分别于0、2、4、8、12和24 h吸取100 μL菌悬液进行平板稀释菌落计数。绘制时间-杀菌曲线[10]。
耐药筛选实验
通过药敏实验检测PVB和OXA的MIC,将1/2×MIC孔中的菌悬液和MH肉汤按1꞉1000倍稀释后,向96孔板中每孔加入50 μL稀释后菌悬液。再每孔分别加入50 μL用MH肉汤分别倍比稀释至1/16-8×MIC的PVB和/或OXA,轻轻混匀后置于湿盒中,在37 ℃下恒温孵育24 h。记录MIC值,并将1/2×MIC孔中的菌悬液按1꞉1 000倍稀释后继续进行MIC检测。如此往复监测15 d,记录每天的MIC值[11]。
生物被膜清除实验
挑取新鲜菌落于TSB中,于37 ℃以180 r/min摇菌培养24 h至平台期。将菌悬液用新鲜TSB按1꞉200稀释后,向96孔板中每孔加入200 μL。于37 ℃静置孵育24 h,使其形成生物被膜。弃去上清,每孔加入200 μL生理盐水,漂洗3次。然后每孔加入200 μL用TSB稀释后的PVB和/或OXA,然后于37 ℃继续孵育24 h后弃去上清,用生理盐水漂洗3次后弃上清。每孔再分别加入200 μL 0.25%(w/v)结晶紫染液,于室温下静置孵育15 min后弃上清,用生理盐水漂洗3次。待晾干后检测570 nm处的A值,即为生物被膜的相对量[11]。
激光共聚焦显微镜观察生物被膜形态
将培养至对数生长期的表皮葡萄球菌RP62A用新鲜TSB按1꞉200稀释后,向6孔板中每孔加入2 mL,再加入一块10 mm×10 mm无菌盖玻片。将6孔板置于37 ℃恒温培养箱中静置孵育24 h构建生物被膜。用PBS轻轻漂洗3次,以去除未与玻片结合的浮游菌,每孔再分别加入1×MIC浓度的PVB和/或OXA。加有DMSO的孔设置为对照。将6孔板放置恒温培养箱中于37 ℃下继续孵育24 h,用PBS漂洗3次后,向每块玻片上分别滴加数滴10 μmol/L的SYTO/PI (体积比1꞉1)混合液。置于4 ℃下避光孵育15 min,用PBS漂洗掉多余的荧光染液,通过激光共聚焦显微镜观察生物被膜的形态结构[10]。
持留菌计数实验
将RP62A摇菌培养至平台期,用TSB按1꞉200稀释后,向96孔板中每孔加入200 μL,于37 ℃下静置孵育24 h构建生物被膜。弃去上清,每孔分别加入200 μL 含有100 μg/mL的VAN。于37 ℃下孵育4 h后弃上清,每孔再分别加入PVB或OXA或两者联用。分别于0、1、2、3和4 h,用移液器Tip头打散生物被膜,充分混匀后,吸取100 μL进行平板稀释菌落计数[12]。
透射电镜观察
将表皮葡萄球菌RP62A在TSB肉汤中培养2~4 h至对数生长期,以4 000 g离心8 min取沉淀。用1×PBS(pH=7.4)洗涤沉淀2次后,加入5×MIC PVB,于37 ℃下摇菌孵育1 h。再以4 000 g离心8 min收集沉淀,加入1 mL戊二醛固定样品,并用0.1 mol/L二甲酰二甲酸缓冲液洗涤沉淀。用1%四氧化锇/1.5%亚铁氰化钾固定1 h后洗涤,并在含有1%乙酸铀酰的马来酸缓冲液中孵育1 h。在水中洗涤2次后,用乙醇梯度浓度脱水,在环氧丙烷中孵育1 h后进行包埋,并在60 ℃下聚合48 h。在切片机上切割超薄切片,收集于铜网格上,用柠檬酸铅染色。采用透射电镜观察细菌超微结构[13]。
ROS定量实验
用H2DCFDA探针检测ROS。首先,将表皮葡萄球菌RP62A在TSB肉汤中培养2~4 h至对数生长期,洗涤并重悬在1×PBS中至A600 nm=0.5。将细菌悬浮液与10 μmol/L H2DCFDA避光孵育30 min。再用PBS洗涤2次后,将10 μL PVB或OXA或PVB+OXA加入到90 μL制备的细菌悬浮液中孵育30 min。随后,在激发波长488 nm和检测波长525 nm下检测荧光强度[14]。
ATP定量实验
将表皮葡萄球菌RP62A在TSB肉汤中培养2~4 h至对数生长期,洗涤后重悬于1×PBS中并调节至 A600 nm=0.5。用PVB或OXA或PVB+OXA处理1 h后,于4 ℃下以4 000 g离心8 min取沉淀。分别加入100 μL至96孔板中,再分别加入100 μL工作液,采用酶标仪检测荧光强度[15]。
统计学处理
采用GraphPad 8.0统计学软件进行分析。计量资料采用均数±标准差(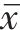
结 果
PVB与OXA联用具有协同抗菌活性
通过微量肉汤稀释实验测得RP62A对PVB和OXA的MIC均为8 μg/mL。棋盘稀释实验显示PVB与OXA联用具有明显的协同抗菌作用,其FICI为0.25(图1A)。进一步通过时间-杀菌曲线发现1/4×MIC的PVB或OXA对表皮葡萄球菌无杀菌作用或仅有轻微的杀菌作用;而当两药联用时,可显著降低活菌数量,作用12 h即可完全杀灭表皮葡萄球菌,且抑制效果长达24 h(图1B)。此外,PVB与OXA联用对临床分离菌株均有明显的协同作用,其FICI值为0.187 5~0.500 0(表1)。
| S. epidermidis | Drugs | MICalone | MICcombined | Fold change | FICI | Outcome |
|---|---|---|---|---|---|---|
| SEP101 | PVB | 8.000 | 2.000 0 | 0.250 0 | 0.500 0 | Synergy |
| OXA | 0.125 | 0.031 3 | 0.250 0 | |||
| SEP102 | PVB | 8.000 | 2.000 0 | 0.250 0 | 0.375 0 | Synergy |
| OXA | 0.250 | 0.031 3 | 0.125 0 | |||
| SEP103 | PVB | 8.000 | 1.000 0 | 0.125 0 | 0.187 5 | Synergy |
| OXA | 4.000 | 0.250 0 | 0.062 5 | |||
| SEP104 | PVB | 4.000 | 0.500 0 | 0.125 0 | 0.375 0 | Synergy |
| OXA | 0.500 | 0.125 0 | 0.250 0 | |||
| SEP105 | PVB | 8.000 | 1.000 0 | 0.125 0 | 0.375 0 | Synergy |
| OXA | 0.125 | 0.031 3 | 0.250 0 | |||
| SEP106 | PVB | 8.000 | 2.000 0 | 0.250 0 | 0.500 0 | Synergy |
| OXA | 0.125 | 0.031 3 | 0.250 0 | |||
| SEP107 | PVB | 8.000 | 0.500 0 | 0.062 5 | 0.312 5 | Synergy |
| OXA | 0.250 | 0.062 5 | 0.250 0 | |||
| SEP108 | PVB | 4.000 | 1.000 0 | 0.250 0 | 0.500 0 | Synergy |
| OXA | 0.125 | 0.031 3 | 0.250 0 |
PVB抑制OXA耐药的产生
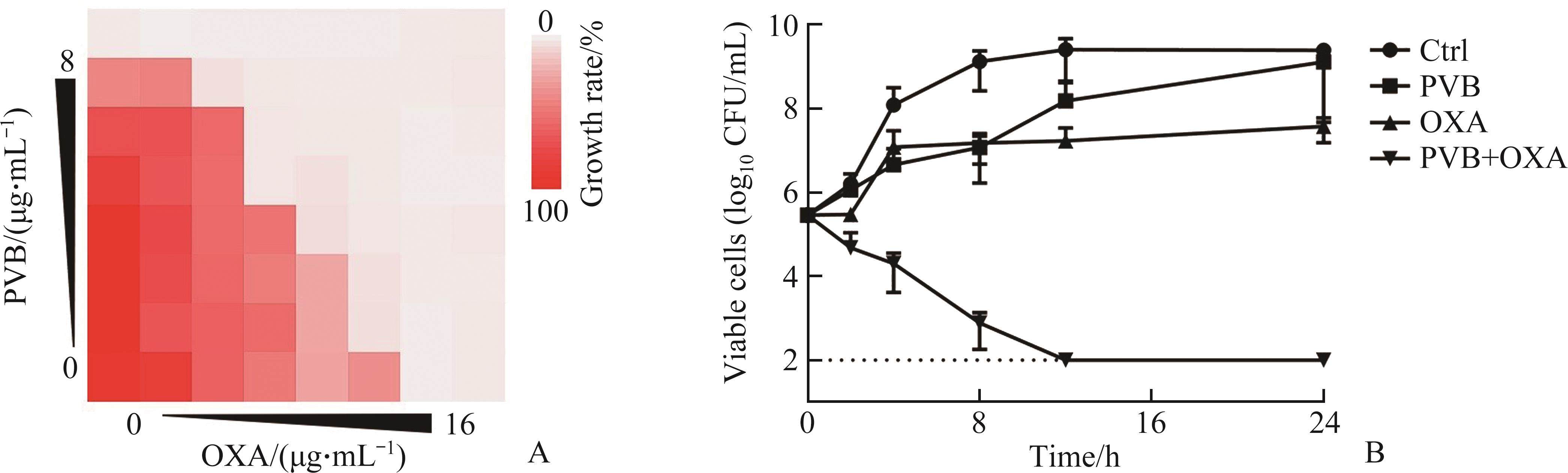
微量肉汤稀释实验测得环丙沙星(ciprofloxacin,CIP)对RP62A的MIC为0.5 μg/mL。亚抑菌浓度CIP连续诱导15 d,可使CIP的MIC上升64倍。而即使亚抑菌浓度的PVB连续诱导15 d,其对RP62A的MIC始终维持在8 μg/mL。亚抑菌浓度的OXA与表皮葡萄球菌作用15 d,可使其MIC上升16倍,而当OXA中加入1/8×MIC的PVB时,可显著抑制OXA引起的耐药,使OXA的MIC始终维持在0.5 μg/mL(图2)。
PVB促进OXA的生物被膜清除作用和抗持留菌活性
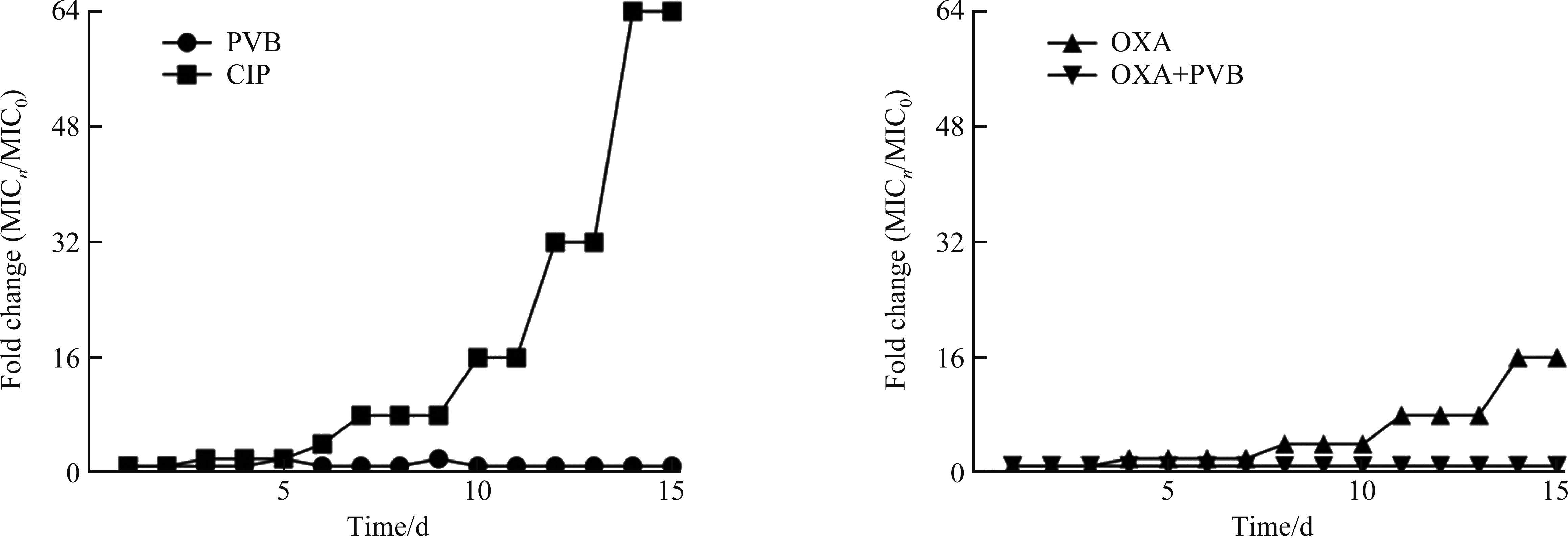
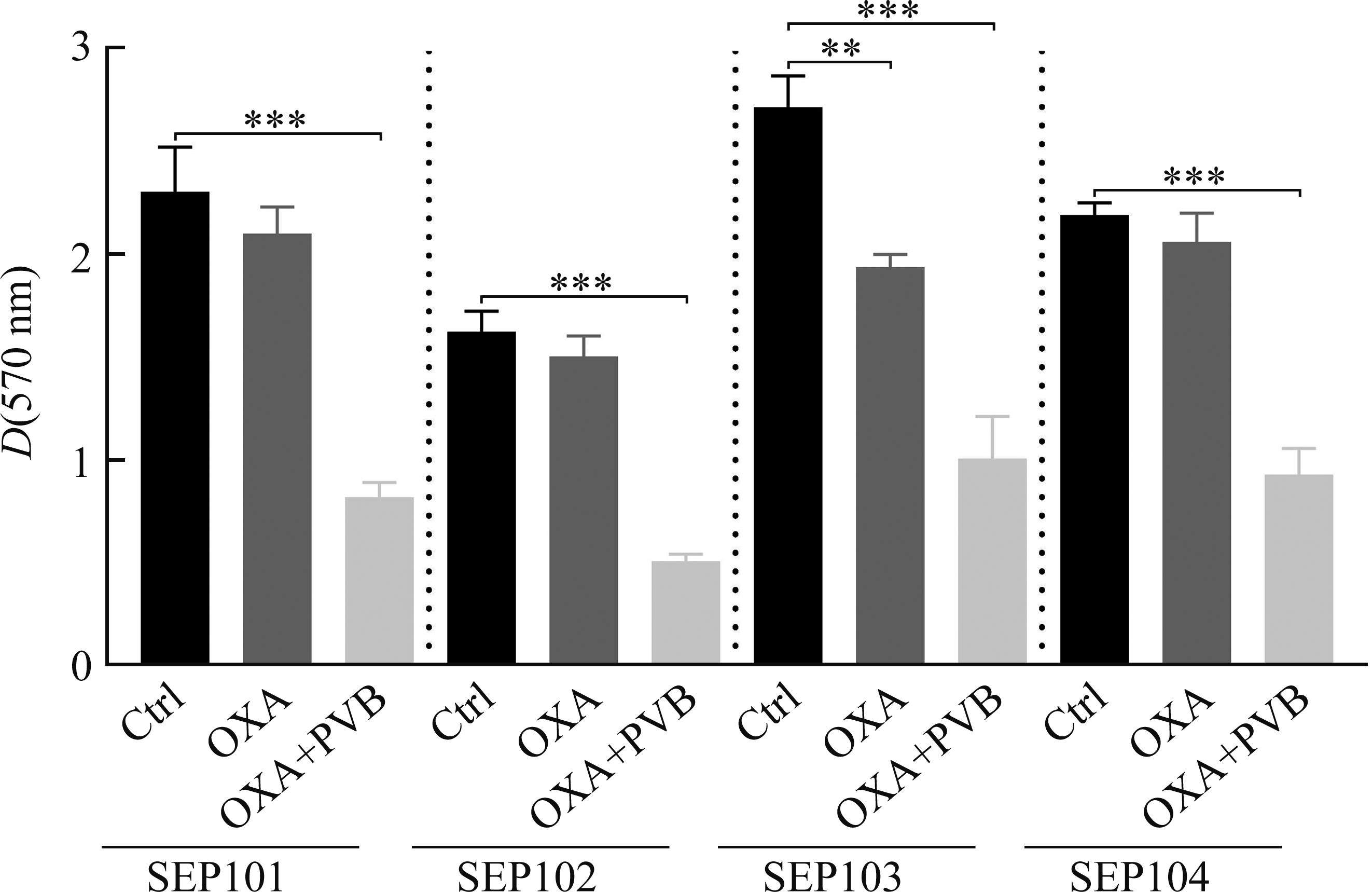
1/2×MIC的PVB或1×MIC OXA对表皮葡萄球菌已形成的生物被膜无清除作用,而当两者联用时,可使生物被膜的总量从(2.36±0.46)减少到(1.12±0.39) (t=3.504,P=0.02;图3A)。SYTO9/PI荧光染色发现:用PVB单独处理表皮葡萄球菌生物被膜时仅有微弱的清除作用,单用OXA时无抗生物膜作用,而当两者联用时,可明显降低生物被膜总量,且增加死亡细菌比例(图3B),即总体低荧光强度降低(图3C),红色荧光比例增加(图3D)。PVB和OXA联用还可协同降低生物被膜中的持留菌数量,且随着作用时间延长,其抗菌效果更佳。当PVB联用OXA作用于持留菌4 h时,可使持留菌的总量从lg(7.73±0.21)减少到lg(2.79±0.43) (t=4.143,P=0.014;图3E)。随后,选取4株临床分离菌株对PVB联用OXA的协同抗生物被膜效果进行验证,发现单独使用OXA不能或仅轻度清除临床菌株表皮葡萄球菌生物被膜,当加入 1/8×MIC的PVB时,可显著提高OXA对生物被膜的清除能力(图4)。
PVB的抗菌机制
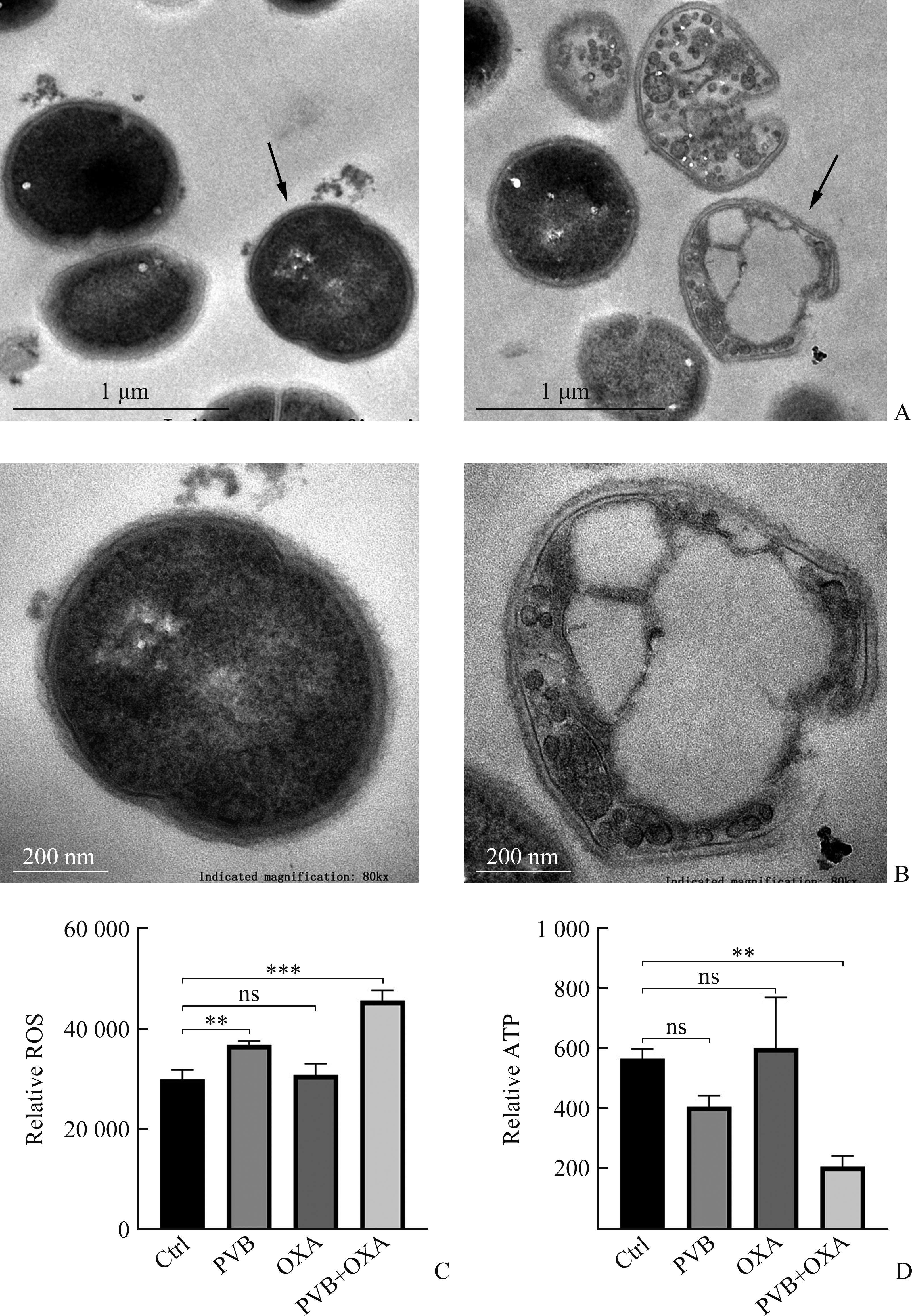
透射电镜观察发现PVB可明显破坏表皮葡萄球菌正常细胞结构,使细胞壁坍塌,细胞内容物外排消失,且细胞膜聚集成囊泡状(图5A)。这可能是PVB破坏了细菌能量的产生,从而无法维持细胞内外渗透压。ROS定量发现:PVB单独使用即可促进ROS的形成,而当OXA与PVB联用时,则可显著促进细菌产生ROS,使其相对荧光强度从(29 966.67±1 903.51)升高到(45 666.67±2 081.67) (t=10.42,P<0.001;图5B)。进一步通过ATP检测发现PVB和OXA联用可显著降低ATP的生成,使ATP的产量从(565±33.18)减少到(205.67±35.23) (t=4.932,P=0.003;图5C)。因此,PVB联用OXA的抗菌机制可能涉及ROS的产生增多和ATP的合成减少。
讨 论
表皮葡萄球菌易黏附于医疗器械表面形成耐药性极高的生物被膜,可随着侵入性操作进入人体而引起感染。目前,尚无有效抗生素能清除已形成的生物被膜。因此,新型抗菌药物的研发已成为当下热点。本研究通过药物重新利用,发现治疗肠易激综合征药物PVB联用OXA对表皮葡萄球菌及其生物被膜和持留菌具有显著的协同抗菌效果,并通过机制实验揭示PVB的作用机制主要涉及ROS的产生。
耐甲氧西林表皮葡萄球菌的流行具有明显的地域区别,欧洲国家占比较高,其表皮葡萄球菌相关感染中,耐甲氧西林分离株占比60%~70%。长时程住院、滥用广谱抗生素或使用多种抗生素、长期抗生素治疗、手术伤口、医疗机械、中心静脉或使用导尿管等原因都能增加耐甲氧西林表皮葡萄球菌的发生率[16]。耐甲氧西林表皮葡萄球菌对OXA的耐药性普遍存在[17]。此外,OXA可引起肝毒性,大剂量注射还能导致神经毒性[18]。因此,寻找能有效改善OXA的抗菌活性并降低其耐药性的佐剂具有较大的临床意义。本研究中,PVB能有效提高OXA的抗菌能力,并显著改善其耐药形成的能力。因此,PVB有望成为OXA的佐剂,通过提高OXA的抗菌能力降低OXA的使用剂量,从而降低OXA的毒性,提高其使用价值并延缓细菌耐药性的产生,增强临床实用性。
与本研究类似,Mao等[7]发现PVB对金黄色葡萄球菌也具有杀菌活性,其MIC50和MIC90分别为12.5 μmol/L(约7.39 μg/mL)和25 μmol/L(约14.79 μg/mL)。而本研究测得PVB对表皮葡萄球菌的MIC为8 μg/mL,因此,PVB对表皮葡萄球菌和金黄色葡萄球菌具有相似的抗菌活性。此外,Mao等[7]发现PVB对金黄色葡萄球菌的生物膜和持留菌也具有一定的抗菌作用,PVB对金黄色葡萄球菌的抗菌机制主要涉及细胞膜渗透性的破坏,而本研究对表皮葡萄球菌的抗菌机制主要涉及ROS的诱导。
PVB是一种钙离子通道阻断剂,毒副作用小且具有良好的人体耐受性。一项研究[19]通过纳入117例消化功能不良的患者,对比PVB和多潘立酮的治疗效果和安全性。结果显示:治疗4周后,PVB组的患者效果显著优于多潘立酮组,且不良反应与多潘立酮组差异无统计学意义,提示PVB安全性高。究其原因,一方面,PVB的血浆蛋白结合率高,为95%~98%,代谢速度快,在人体作用的时间较短;另一方面,PVB的全身吸收能力较差,对胃肠道具有选择性,而对心血管系统基本无药理作用,且PVB无抗胆碱能作用,因此对心血管系统无毒副作用[20-21]。
PVB的作用机制主要涉及ATP的合成减少和ROS的产生增多。促进ROS产生是诸多抗菌药物共同的作用机制。ROS主要包括O2•-、•OH和过氧化氢(hydrogen peroxide,H2O2),这些活性成分可以损伤细胞结构中的大分子,包括蛋白质、脂质和核酸等,最终导致细菌死亡[22]。如,纳米银可通过诱导铜绿假单胞菌产生ROS而起到杀菌作用[23];有氧条件下,纳米铜可通过诱导ROS在周浆间隙中聚集,从而促进蛋白质凝集而发挥有效抗菌作用[24];衣康酸可通过促进磷酸戊糖代谢途径而产生ROS,从而同时发挥抗炎和抗菌的作用[25]。此外,近年来新发现的抗菌药物如羟基查韦斯醇、儿茶素、没食子酸酯和一些酚类等均能通过诱导ROS的产生而发挥抗菌作用[22]。
综上所述,PVB联用OXA对表皮葡萄球菌及其生物被膜和持留菌均具有显著的协同抗菌作用。PVB可抑制ATP的合成并诱导ROS的产生从而发挥抗菌活性。PVB是已上市的肠易激综合征首选治疗药物,合成路线成熟且毒副作用明确,有望与OXA联用成为难治性表皮葡萄球菌生物被膜相关感染的替代药物。
Overview of Staphylococcus epidermidis cell wall-anchored proteins: potential targets to inhibit biofilm formation
[J]. Mol Biol Rep, 2020, 47(1): 771-784. https://doi.org/10.1007/s11033- 019-05139-1.Staphylococcus aureus and Staphylococcus epidermidis infections on implants
[J]. J Hosp Infect, 2018, 98(2): 111-117. https://doi.org/10. 1016/j.jhin.2017.11.008.A new class of synthetic retinoid antibiotics effective against bacterial persisters
[J]. Nature, 2018, 556(7699): 103-107. https://doi.org/10.1038/nature26157.Felodipine enhances aminoglycosides efficacy against implant infections caused by methicillin-resistant Staphylococcus aureus, persisters and biofilms
[J]. Bioact Mater, 2021, 14: 272-289. https://doi.org/10. 1016/j.bioactmat.2021.11.019.Repurposing eltrombopag as an antimicrobial agent against methicillin-resistant Staphylococcus aureus
[J]. Front Microbiol, 2021, 12: 790686. https://doi.org/10.3389/fmicb.2021.790686.Efficacy of pinaverium bromide in the treatment of irritable bowel syndrome: a systematic review and meta-analysis
[J]. Therap Adv Gastroenterol, 2021, 14: 17562848211033740. https://doi.org/10. 1177/17562848211033740.In vitro inhibition of growth, biofilm formation, and persisters of Staphylococcus aureus by pinaverium bromide
[J]. ACS Omega, 2023, 8(10): 9652-9661. https://doi.org/10.1021/acsomega.3c00340.Origanum vulgare L. essential oil as a potential anti-acne topical nanoemulsion—In vitro and in vivo study
[J]. Molecules, 2018, 23(9): 2164. https://doi.org/10.3390/molecules23092164.In vitro activities of antibiotics and antimicrobial cationic peptides alone and in combination against methicillin-resistant Staphylococcus aureus biofilms
[J]. Antimicrob Agents Chemother, 2012, 56(12): 6366-6371. https://doi.org/10.1128/AAC.01180-12.Triple combination of SPR741, clarithromycin, and erythromycin against Acinetobacter baumannii and its tolerant phenotype
[J]. J Appl Microbiol, 2023, 134(1):Evidence for persisters in Staphylococcus epidermidis RP62a planktonic cultures and biofilms
[J]. J Med Microbiol, 2011, 60(Insights into the antimicrobial effects of ceritinib against Staphylococcus aureus in vitro and in vivo by cell membrane disruption
[J]. AMB Express, 2022, 12(1): 150. https://doi.org/10.1186/s13568-022-01492-w.A broad-spectrum antibiotic adjuvant reverses multidrug-resistant Gram-negative pathogens
[J]. Nat Microbiol, 2020, 5(8): 1040-1050. https://doi.org/10. 1038/s41564-020-0723-z.Metformin restores tetracyclines susceptibility against multidrug resistant bacteria
[J]. Adv Sci, 2020, 7(12): 1902227. https://doi.org/10.1002/advs.201902227.MRSA and MRSE: is there an answer?
[J]. Clin Microbiol Infect, 2000, 6(Associated outcomes of different intravenous antibiotics combined with 2% mupirocin ointment in the treatment of pediatric patients with staphylococcal scalded skin syndrome
[J]. Clin Cosmet Investig Dermatol, 2023, 16: 1691-1701. https://doi.org/10.2147/CCID.S417764.Systematic review and meta-analysis of the safety of antistaphylococcal penicillins compared to cefazolin
[J]. Antimicrob Agents Chemother, 2018, 62(4):匹维溴铵片治疗功能性消化不良的效果和安全性研究
[J]. 中国现代药物应用, 2022, 16(20): 32-35. https://doi.org/10.14164/j.cnki.cn11-5581/r.2022.20.008.Clinical efficacy of cognitive behavioral therapy combined with pinaverium bromide tablets on irritable bowel syndrome
[J]. Pak J Med Sci, 2023, 39(4): 1013-1017. https://doi.org/10.12669/pjms.39.4.6994.Efficacy of the combination of pinaverium bromide 100 mg plus simethicone 300 mg in abdominal pain and bloating in irritable bowel syndrome: a randomized, placebo-controlled trial
[J/OL]. J Clin Gastroenterol, 2020, 54(4): e30-e39[Redox impact on bacterial macromolecule: a promising avenue for discovery and development of novel antibacterials
[J]. Biomolecules, 2022, 12(11): 1545. https://doi.org/10.3390/biom12111545.Antibacterial activity and mechanism of silver nanoparticles against multidrug-resistant Pseudomonas aeruginosa
[J]. Int J Nanomedicine, 2019, 14: 1469-1487. https://doi.org/10.2147/IJN.S191340.Copper induces protein aggregation, a toxic process compensated by molecular chaperones
[J/OL]. mBio, 2022, 13(2): e0325121[Itaconic acid exerts anti-inflammatory and antibacterial effects via promoting pentose phosphate pathway to produce ROS
[J]. Sci Rep, 2021, 11(1): 18173. https://doi.org/10.1038/s41598-021-97352-x.作者声称无任何利益冲突。
袁乐宏, 佘鹏飞. 匹维溴铵与苯唑西林联用对表皮葡萄球菌的协同抗菌作用[J]. 中南大学学报(医学版), 2024, 49(10): 1601-1610. DOI:10.11817/j.issn.1672-7347.2024.240109
YUAN Lehong, SHE Pengfei. Synergistic antibacterial effects of pinaverium bromide and oxacillin against Staphylococcus epidermidis[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1601-1610. DOI:10.11817/j.issn. 1672-7347.2024.240109
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101601.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.240109

