RNA干扰(RNA interference,RNAi)是生物体内保守基因表达调控的机制[1]。导入外源双链RNA(double-stranded RNA,dsRNA)可抑制同源内源性基因表达[2-3]。小干扰RNA(small interfering RNA,siRNA)是一种由19~25个碱基对组成的dsRNA,与细胞质中的RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)结合,导致信使RNA(messenger RNA,mRNA)序列断裂,抑制特定基因的表达[4-6]。RNAi在治疗包括病毒感染、癌症和自身免疫性疾病等多种疾病中具有重要潜力[7-8]。但siRNA等核酸分子在组织和细胞中非常不稳定,易被核酸酶降解,且核酸分子带负电荷、分子量较大,很难透过细胞膜,为此核酸递送载体技术应运而生。
含有阳离子脂质的脂质体(liposome,LP)作为核酸递送载体受到了广泛关注[9-10],其通过静电作用与核酸复合,可有效避免核酸酶降解将核酸药物递送至细胞质,但其毒性较大无法进入临床。赖氨酸基可电离阳离子脂质是一类具有亲水性氨基头基(5<pKa<7)的脂质化合物,其氨基头基在弱酸性(如pH 5.0)环境下带正电荷,可以与带负电荷的核酸药物结合实现对药物的有效装载并实现内涵体、溶酶体逃逸[11-12];在生理pH值下为中性,大大降低了毒性。
信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)是经典致癌信号通路中重要的信号转导蛋白。在胃癌中,白细胞介素(interleukin,IL)-26激活的STAT3诱导上调抗凋亡基因[B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、B细胞超大淋巴瘤(B-cell lymphoma-extra large,Bcl-xL)等[13]]和一些原癌基因[细胞-骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)等]的表达[14],导致细胞持续增殖。STAT3参与的信号通路同样存在于子宫内膜癌[15]、膀胱癌[16]和结肠癌[17]等多种肿瘤中,是具有前景的肿瘤治疗靶点。
本研究通过合成一种新型可电离脂质化合物Nε-月桂酰基赖氨酸酰胺(Nε-laruoyl-lysine amide,LKA),该化合物可被制备为脂质体,用于包载STAT3-siRNA(LKA-LP@STAT3-siRNA),并通过细胞实验初步探究其对siRNA的递送能力,为进一步开发核酸药物奠定基础。
材料与方法
主要仪器和试剂
核磁共振波谱仪(型号Advance 400 MHz)和四级杆飞行时间质谱仪(型号Compact QqTOF)为自德国布鲁克(Bruker)公司产品;酶标仪(型号Multiskan FC)为上海赛默飞世尔仪器有限公司产品;qPCR仪(型号Quant Studio 5)为美国Applied Biosystems公司产品;马尔文激光粒度分析仪(型号Mastersizer 2000)为英国马尔文仪器有限公司产品;高内涵成像系统(PerkinElmer Operetta CLSTM)为美国PerkinElmer公司产品。
Nα-苄氧羰基-L-赖氨酸购自成都市科隆化学品有限公司;尼罗红(Nile Red)购自北京百灵威科技有限公司;二氯亚砜购自美国西格玛奥德里奇贸易有限公司;核酸荧光染料Gel Red购自上海研谨生物科技有限公司;钯碳、碳酸氢钠、甲醇均购自国药集团化学试剂有限公司;乙醇购自天津富宇精细化工有限公司;月桂酰氯、乙酸乙酯、浓氨水均购自上海麦克林生化科技股份有限公司;氯化氢购自巴斯夫中国有限公司;三乙胺购自上海泰坦科技股份有限公司;氯化亚砜购自山东华鲁恒升化工股份有限公司;胎牛血清、细胞培养基均购自美国Gibco公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自美国Bioss公司。
肺腺癌细胞株A549、小鼠胚胎成纤维细胞株3T3和人宫颈癌细胞株Hela均购自湖南丰晖生物科技有限公司。
方法
LKA的制备及表征
合成分为甲酯化、酰胺化、酰化和脱保护基4个反应步骤(图1)。
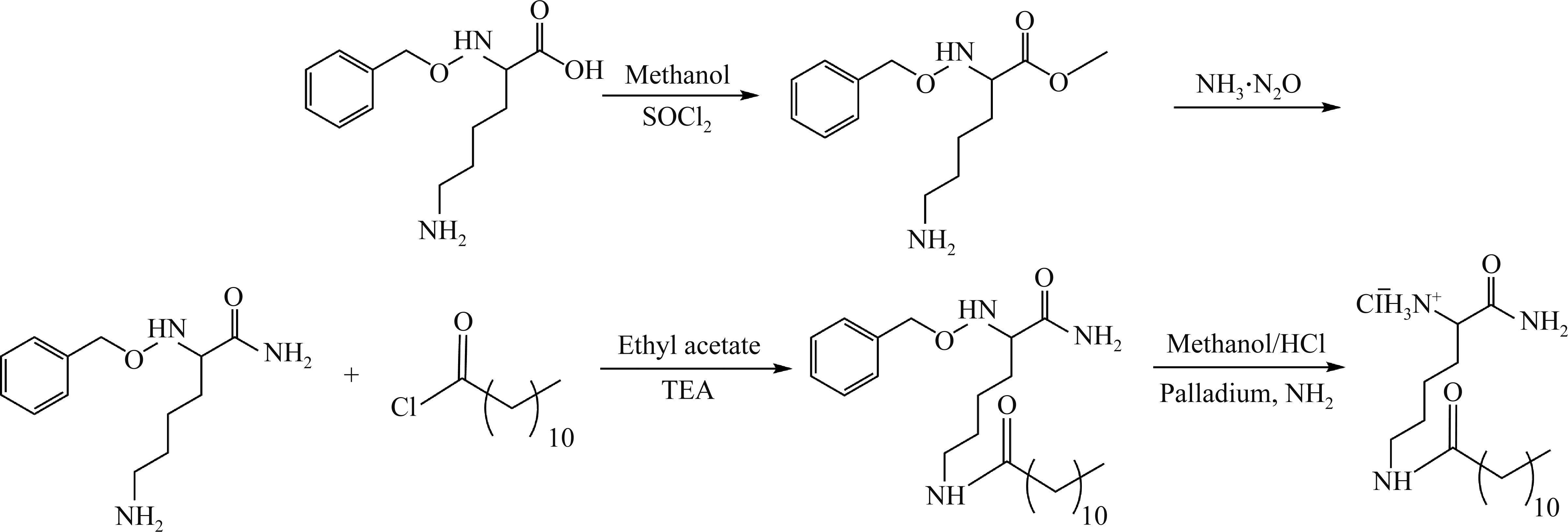
甲酯化反应:Nα-苄氧羰基-L-赖氨酸(15 mmol)溶于甲醇(80 mL),-10 ℃乙醇浴中搅拌冷却10~30 min,逐滴加入二氯亚砜(70 mmol),转室温继续搅拌20 h,薄层层析(thin-layer chromatography,TLC)监测反应进程,反应结束后减压蒸发得到淡黄色固体,50 ℃下真空干燥得到酯化反应产物Nα-苄氧羰基赖氨酸甲酯。
酰胺化反应:取上一步酯化产物(12 mmol)溶于浓氨水(50 mL),-5 ℃乙醇浴中搅拌反应24 h,抽滤得到酰胺化产物。TLC监测反应进程,反应结束后抽滤得到白色固体,50 ℃下真空干燥得到酰胺反应产物Nα-苄氧羰基赖氨酰胺。
酰化反应:取上一步酰胺化产物(10 mmol)和三乙胺(3 mL)溶于乙酸乙酯(80 mL)中,-5 ℃乙醇浴中搅拌冷却10~30 min,逐滴加入月桂酰氯(11 mmol),转室温继续搅拌反应4 h,减压蒸发除去溶剂得到粗产物。粗产物中加入饱和碳酸氢钠溶液(50 mL)在45 ℃下搅拌反应15 min,用等体积、饱和氯化钠溶液洗涤2~3次,减压蒸发得到白色固体,50 ℃下真空干燥得到酰化反应产物Nα-苄氧羰基-Nε-月桂酰基赖氨酸酰胺。
脱保护基反应:取上一步酰化产物(8 mmol)溶于甲醇(40 mL)中,加入氯化氢/甲醇溶液调节pH值为3~4,以钯碳(10% Pd)为催化剂,通氢气反应4 h,用硅藻土滤除催化剂,减压蒸发除去溶剂得到粗产物,甲醇/丙酮重结晶后获得目标产物LKA。
每一步反应的产物都以氘代二甲基亚砜(dimethyl sulfoxide-d6,DMSO-d6)为溶剂测试核磁共振氢谱,目标产物溶解至色谱级甲醇中进行质谱检测,正离子模式。
纸电泳实验
配制不同pH值(pH 7.4、6.5、5.5)的邻苯二甲酸氢钾缓冲溶液。丙氨酸(等电点为6.02)在pH 5.5(即溶酶体pH条件下)时带正电荷,故以丙氨酸为阳性对照。用毛细管将1% LKA溶液或丙氨酸溶液点在样品条的中心,吹风机吹干,将样品条两端用茚三酮溶液浸湿。将点样条放入电泳仪,电压300 V,电泳 30 min。电泳完成后烘干样品条显示色斑。
乙醇注入法制备脂质体
脂质乙醇相:氢化大豆磷脂酰胆碱(hydrogenated soybean phosphatidylcholine,HSPC)、胆固醇(cholesterol,CHOL)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2 000(distearoyl phosphatidylethanolamine-polyethylene glycol 2 000,DSPE-PEG2 000)和LKA按质量比1꞉1꞉1꞉1溶于1 mL乙醇,其中LKA的最终浓度为1 mg/mL。
空白脂质体(LKA-LP)的制备:4 mL pH 5.0醋酸缓冲溶液(水相)与脂质乙醇相分别预热至55 ℃,55 ℃下边搅拌边将脂质乙醇相缓慢注入水相中,持续搅拌至乙醇完全挥发,总脂质的终浓度为1 mg/mL。冰水浴中超声3~4次,采用30 kD(1 D=1 u)超滤管纯化得到有乳光的透明液体,即脂质体。于在4 ℃冰箱中保存备用。
包载STAT3-siRNA的脂质体(LKA-LP@STAT3-siRNA)的制备:STAT3-siRNA溶于4 mL pH 5.0醋酸缓冲溶液(水相),STAT3-siRNA与LKA的氮磷比为1꞉10。按照上述步骤制备脂质体。
包载尼罗红的脂质体(LKA-LP@Nile Red)的制备:将尼罗红溶于脂质乙醇相中,尼罗红质量与总脂质质量比为1꞉10,水相为4 mL pH 5.0醋酸缓冲溶液,然后按照上述步骤制备脂质体。
表征和稳定性试验
将脂质体溶液滴到碳涂层铜网格上,干燥后用扫描电子显微镜(scanning electron microscope,SEM)对脂质体的形态进行成像。
马尔文激光粒度分析仪分别在磷酸盐缓冲液(phosphate buff ered saline,PBS)和10%胎牛血清(fetal bovine serum,FBS)培养基中检测脂质体的粒径、多分散性指数(polydispersity,PDI)及Zeta电位(Zeta potential,ZP)。将脂质体保存在4 ℃环境中,每24 h检测1次,共检测7 d。
药物包封率测定
采用琼脂糖凝胶电泳检测包封率,LKA-LP@STAT3-siRNA(实验组)和等浓度STAT3-siRNA(对照组)分别加入肝素和甲醇,于冰水浴中超声 5 min,加入上样缓冲液。制备35 g 1%的琼脂糖凝胶,加入核酸荧光染料Gel Red3.5 μL混匀,上样,电泳电压80 V,时间40 min。凝胶成像仪拍摄,Image J统计灰度值并计算包封率。
细胞摄取实验
Hela、3T3细胞以6×103/孔的细胞量分别接种到96孔板中,37 ℃孵育24 h,弃液,用Hoechst 33342孵育10 min,洗去,加入100 μL LKA-LP@Nile Red孵育5 min,PBS清洗细胞,加入培养基,进行细胞荧光成像。
溶酶体逃逸能力的检测
制备包载花菁5(Cyanine 5,Cy5)标志siRNA的脂质体LKA-LP@STAT3-siRNA-Cy5。将A549细胞以8×103/孔的细胞量分别接种到96孔板中孵育24 h,弃液,加入LKA-LP@STAT3-siRNA-Cy5(STAT3-siRNA浓度为100 nM),孵育2 h,再加入Hoechst 33342染色10 min,洗去,加入溶酶体绿色荧光探针(Lyso-Tracker Green)染色15 min,洗去,进行细胞荧光成像。红色Cy5信号为STAT3-siRNA-Cy5所在位置,绿色荧光信号为溶酶体所在位置。
基因沉默实验
设置空白组、LKA-LP组和LKA-LP@STAT3-siRNA-Cy5组(siRNA浓度分别为50 nM、100 nM)。将Hela细胞以3×105/孔的细胞量分别接种到6孔板中进行孵育24 h,弃液,加入对应药物继续孵育48 h,弃液,用预冷的PBS清洗2~3次,加入TRIzol裂解液,采用实时反转录聚合酶链反应(quantitative real-time PCR,qRT-PCR)检测基因沉默效果,以β-actin为内参。PCR反应条件为95 ℃ 15 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 60 s,共进行40个循环。对数据进行分析,基因表达水平用相对定量值(relative quantification,RQ)表示。
目的基因引物和内参引物均由生工生物工程(上海)股份有限公司合成,STAT3引物序列:正向为5'- CTCTTACTTCTCCAGCAACACT-3',反向为5'-ATA-CATGCTACCTAAGGCCAT-3';β-actin引物序列:正向为5'-TAGTTGCGTTACACCCTTTCTTG-3',反向为 5'-TCACCTTCACCGTTCCAGTTT-3'。
细胞活性检测
设置空白组、LKA-LP组和LKA-LP@STAT3-siRNA-Cy5组(siRNA浓度分别为50 nM、100 nM)。将Hela细胞、3T3细胞以1×104/孔的细胞量分别接种到96孔板中进行孵育24 h,弃液,加入对应药物(siRNA浓度分别为50 nM、100 nM)继续孵育6 h,将培养基(100 μL)替换为含有10%(v/v)FBS的DMEM,孵育1 d。将细胞计数试剂盒-8(cell counting kit-8,CCK-8)添加到各孔中孵育1 h,用酶标仪在450 nm处检测吸光度值。细胞存活率=[(药物处理组的吸光度值-纯培基的吸光度值)/(空白组的吸光度值-纯培基的吸光度值)]×100%。
统计学处理
采用GraphPad 8.3统计学软件进行数据分析,计量资料用均数±标准差表示,2组间比较采用t检验,多组间比较采用方差分析,P<0.05为差异有统计学意义。
结 果
可电离阳离子脂质的合成与表征
核磁共振氢谱检测结果显示:在δ8.17质子信号属于-NH3Cl,在δ8.01~7.69出现酰胺质子信号,在δ7.52出现亚氨基质子信号的质子信号在δ3.84~3.61出现次甲基质子信号,在δ1.71、2.99、2.03处均出现亚甲基质子信号,在δ1.56~1.13出现的质子信号峰属于18H烷基链以及亚甲基,在δ0.85出现甲基信号峰(附图1A)。质谱检测结果显示:主峰是328.296 5的离子峰,LKA的[M+H]+理论值为328.296 4,二者相差小于10 ppm(附图1B)。以上结果均说明合成出了目标产物。
纸电泳实验结果显示:pH 5.5条件下电泳30 min后,丙氨酸和LKA都出现了明显的向负极迁移,且迁移距离近似相等;随着pH增大至6.5和7.4,LKA电泳后的显色区域向负极迁移量逐渐减小。这表明LKA具有pH响应性的电荷变化特性,pH降低会使其正电性增大。
LKA-LP@STAT3-siRNA的表征
动态光散射法结果显示:LKA-LP@STAT3-siRNA的粒径为164.1±3.27 nm、PDI为0.174±0.029,粒径分布比较均匀(图2A)。SEM图显示:脂质体呈现球状或近球状,粒径均在150 nm左右,表面圆润光滑,有良好的形态(图2B)。
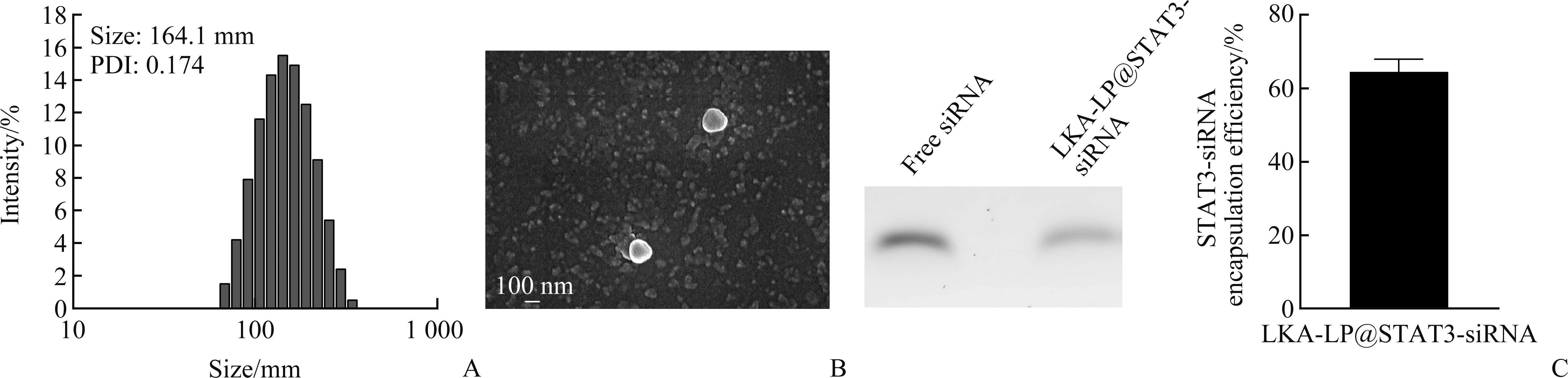
琼脂糖凝胶法检测结果显示:LKA-LP在pH 5.0酸性条件下制备能对siRNA产生较好的包封效果,包封率为64.6%±2.8%(图2C)。
LKA-LP@STAT3-siRNA的储存稳定性
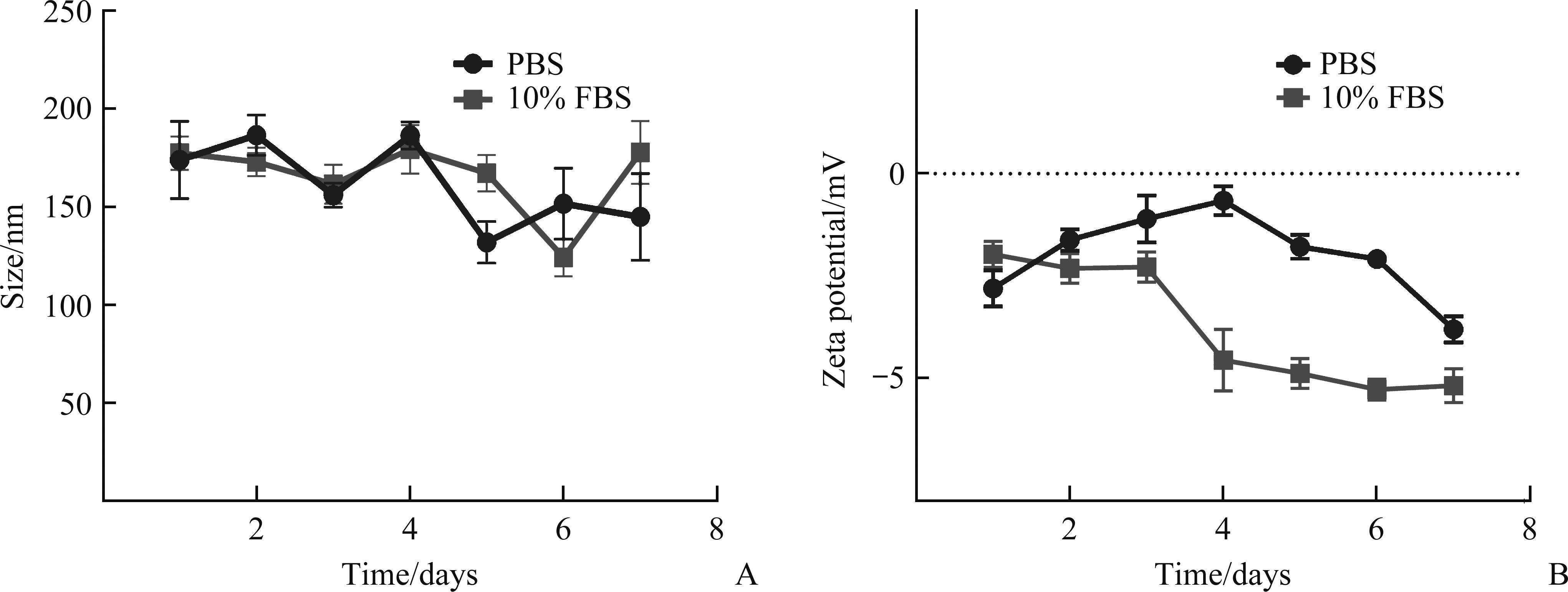
LKA-LP@STAT3-siRNA在PBS或10% FBS溶液中于4 ℃储存7 d,溶液在外观上未出现明显变化。LKA-LP@STAT3-siRNA在2种缓冲溶液中的粒径和表面电势在前3 d内变化都较小;在3 d后保存在10% FBS中的LKA-LP@STAT3-siRNA波动较大,保存在PBS中亦有一定范围的波动但均在可接受范围内(图3)。
LKA-LP@Nile Red细胞摄取能力
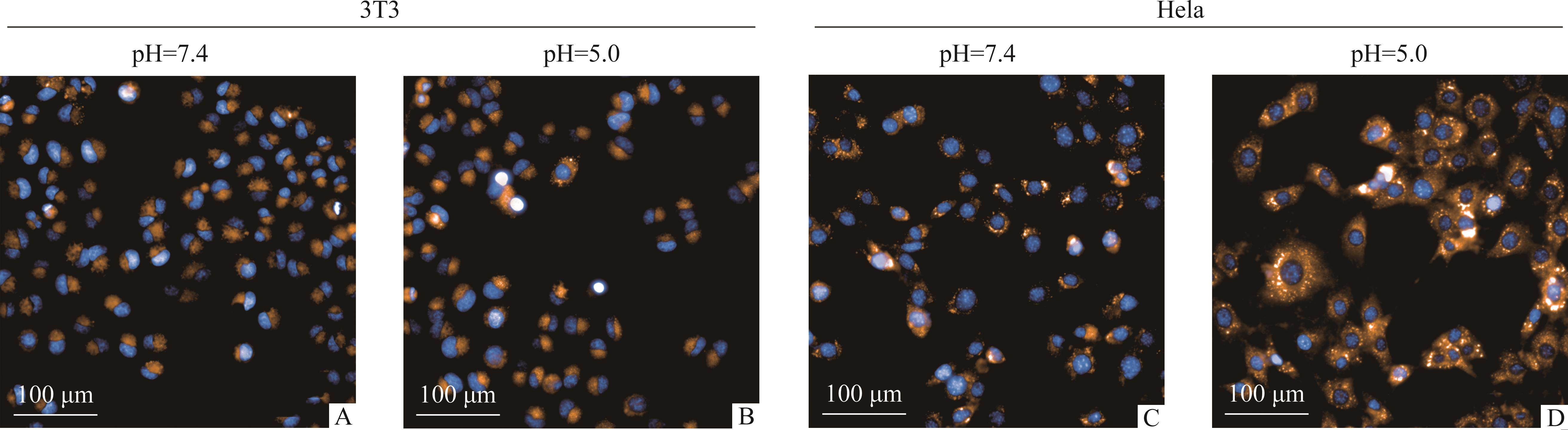
细胞摄取实验结果显示:与LKA-LP@Nile Red孵育5 min后,在Hela和3T3中均观察到尼罗红的荧光信号,值得注意的是,与pH 7.4相比,pH 5.0时2种细胞中尼罗红的荧光信号均增强,且Hela细胞中荧光信号增强更明显(图4)。这表明LKA-LP@Nile Red在pH 5.0的酸性环境中更容易被细胞摄取,且肿瘤细胞比正常细胞摄取得更多。
LKA-LP@STAT3-siRNA-Cy5溶酶体逃逸能力
溶酶体逃逸能力检测结果显示:红色Cy5信号与绿色溶酶体探针信号重叠率约为42.34%(图5)。这说明脂质体避开了溶酶体的降解成功将siRNA递送至胞质。
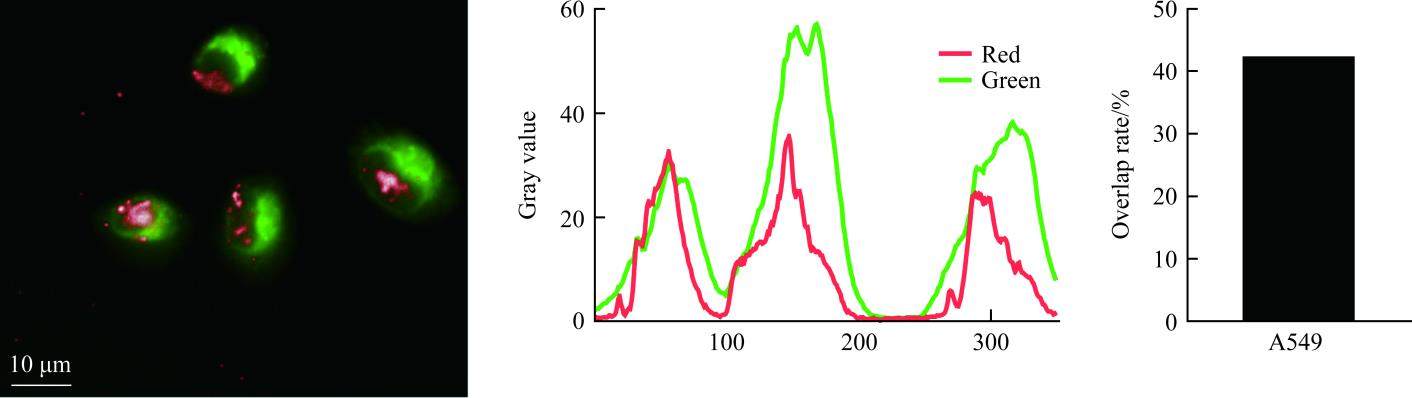
LKA-LP@STAT3-siRNA的基因沉默效果
与空白对照组比较,浓度为50 nM和100 nM的LKA-LP@STAT3-siRNA处理细胞后,细胞中STAT3的mRNA相对表达水平均显著降低(均P<0.01),而LKA-LP处理细胞后,STAT3的mRNA相对表达水平无显著性变化(图6A)。这说明含有LKA的脂质体可以将负载的STAT3-siRNA递送到细胞内,实现STAT3基因沉默。
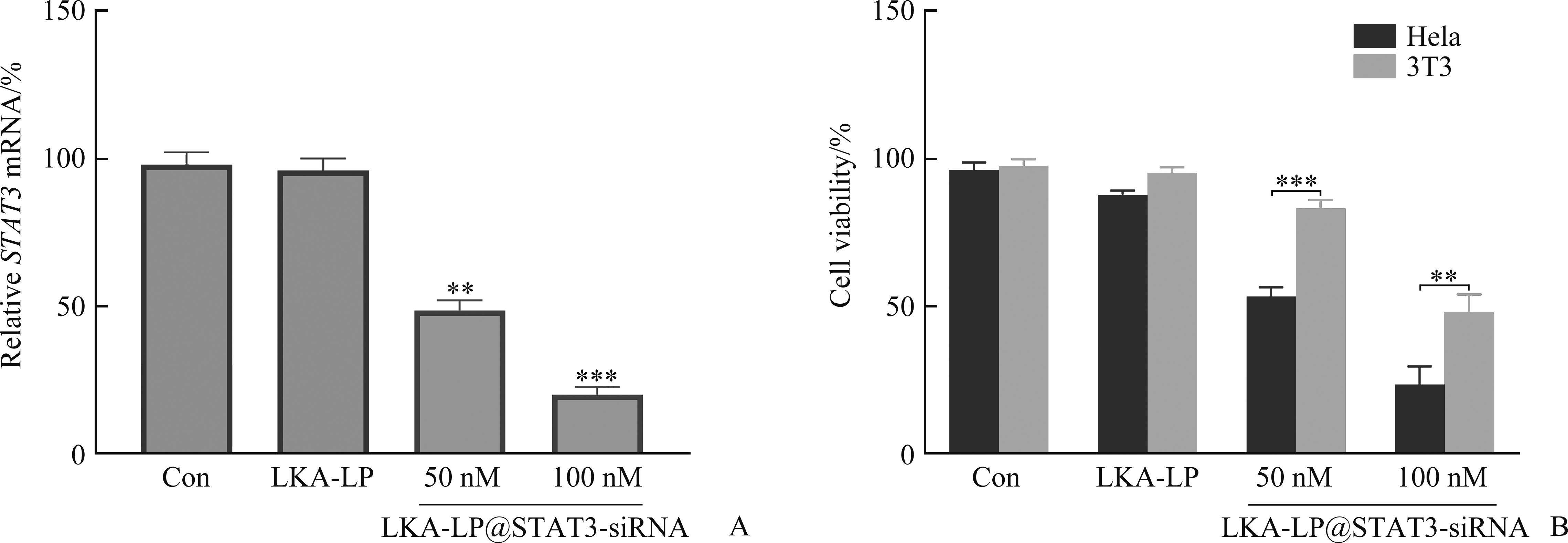
LKA-LP@STAT3-siRNA的特异性细胞毒性
细胞活性结果显示:对照组和LKA-LP组的Hela细胞和3T3细胞活性均在80%以上(P>0.05);经 50 nM和100 nM的LKA-LP@STAT3-siRNA处理后,Hela细胞的存活率显著低于3T3细胞(P<0.01;图6B)。这表明LKA-LP对癌细胞和正常细胞基本无毒性,包载STAT3-siRNA的脂质体LKA-LP@STAT3-siRNA对Hela细胞有特异性杀伤作用。
讨 论
核酸疗法可治疗多种难治性疾病,已成为一个空前活跃的研究领域[18]。核酸疗法实现临床转化的核心是具备高效递送能力和低毒性的合适载体[19]。核酸递送方法分为物理法[20]、病毒载体介导法[13]及非病毒载体介导法[21]。上述方法虽能高效地实现核酸药物直接进入细胞并实现表达,但仍存在可能引起患者不适、损伤组织器官、破坏基因组DNA稳定性、致瘤性、免疫原性等诸多问题。
可电离阳离子脂质由于其易于设计、合成和结构修饰常被用于制备非病毒核酸载体[11, 22-24]。其通常由能够进行质子化的氨基头部、疏水尾部和连接基团3部分组成,在弱酸性条件下带正电荷,在中性条件下为电中性。特殊的结构和pH响应性电荷变化特性,使得可电离阳离子脂质即可以负载核酸,又具有较低的细胞毒性,具有重要研究意义和临床转化潜力。
赖氨酸基可电离阳离子脂质,由赖氨酸与脂肪酸、脂肪胺、脂肪醇等疏水性分子反应合成,二者通过酯键或酰胺键相连,赖氨酸提供亲水性的可电离氨基头基,疏水性分子提供的烷基链为疏水尾部,此外赖氨酸的α-羧基被酯化以屏蔽其负电荷。笔者在前期研究中[25]合成了不同烷基链长的Nε-酰基赖氨酸甲酯:Nε-月桂酰基赖氨酸甲酯、Nε-棕榈酰基赖氨酸甲酯和Nε-硬脂酰基赖氨酸甲酯,并验证了它们有pH响应性的电性变化,还发现它们在μM数量级对于多种肿瘤细胞的毒性比正常细胞更大,而且细胞毒性都是随着烷基链长的增加而增大。笔者推测这是因为肿瘤细胞的细胞外pH低于正常细胞,Nε-酰基赖氨酸甲酯带有更多正电荷所致。不同的是LKA的α-羧基被酰胺化以屏蔽其负电荷,而Nε-月桂酰基赖氨酸甲酯的α-羧基是被甲酯化,由于酯键在pH降低时不稳定,故本研究设计用酰胺键代替。在合成路线的设计上,本研究从α-氨基被保护的赖氨酸出发(Nα-苄氧羰基-L-赖氨酸),先让赖氨酸的α-羧基与甲醇进行甲酯化反应,再利用氨解反应将甲酯转化为酰胺,然后用月桂酰氯作为酰基化试剂,将12个碳原子的疏水尾部连接到赖氨酸的ε-氨基上,最后脱去α-氨基上的保护基苄氧羰基得到目标产物。
本研究中设计合成了一种新型脂质Nε-月桂酰基赖氨酰胺LKA(图1A),与前期研究过的Nε-月桂酰基赖氨酸甲酯相同的是,LKA也具有游离的α-氨基,纸电泳实验表明LKA是一种可电离阳离子脂质,pH降低会使其正电性增强,可以提高其与负电性核酸的结合能力。本研究利用LKA成功制备了LKA-LP@STAT3-siRNA,在酸性环境下将LKA脂质混合液与STAT3-siRNA混合,LKA在该环境下携带正电荷,借助静电作用力能够有效地包载带负电荷的核酸。与此同时,LKA作为典型的两亲性分子,与磷脂等脂质体材料之间可以实现稳定的结合。粒径、PDI和SEM检测结果清晰地显示,LKA能够与常用于制备脂质体的材料共同形成负载STAT3-siRNA的脂质体LKA-LP@STAT3-siRNA,并且在 4 ℃冰箱中保存7 d的时间里,都展现出了良好的稳定性。
肿瘤细胞由于具有Warburg效应,其有氧糖酵解过程十分旺盛,会产生大量的乳酸,导致所处环境相较于正常细胞的酸性更强[26]。本研究中细胞摄取实验表明,含有LKA的脂质体在pH 5.0的酸性环境中更容易被细胞摄取。这是由于LKA在质子化后带上正电荷,这种特性有利于LKA-LP被细胞所摄取,使其在肿瘤治疗中的应用可能具有独特的优势。
赖氨酸有2个氨基(α-氨基和ε-氨基),其中由ε-氨基通过酰胺键连接疏水尾部后,α-氨基成为游离氨基,如Nε-棕榈酰基赖氨酸甲酯和Nε-硬脂酰基赖氨酸甲酯,在内涵体的pH范围内(pH 5.4~7.4),二者都有pH依赖性溶血作用;如果是α-氨基通过酰胺键连接疏水尾部后,ε-氨基成为游离氨基,如Nα-棕榈酰基赖氨酸甲酯的溶血作用无pH依赖性[27]。这是因为赖氨酸2个氨基的pKa值不同,如Nε-棕榈酰基赖氨酸甲酯中α-氨基与Nα-棕榈酰基赖氨酸甲酯中ε-氨基的pKa值分别为5.3和8.1,导致Nε-棕榈酰基赖氨酸甲酯中α-氨基随着pH的降低而质子化程度增加,使极性头部的正电性增强,从而导致红细胞膜破裂;而Nα-棕榈酰基赖氨酸甲酯中ε-氨基一直保持着几乎相同的正电性。本研究LKA使用赖氨酸中的ε-氨基连接疏水尾部,由于α-氨基成为游离氨基,使其在中性环境下不带电毒性大大减小,而LKA在溶酶体的酸性环境中携带了足够的正电荷后,使得溶酶体膜的通透性发生了改变,进而将STAT3-siRNA递送至胞质。基因沉默实验结果进一步表明,逃逸到细胞质中的STAT3-siRNA依然具有活性,能够使Hela细胞的STAT3基因表达显著降低,这也正是LKA-LP@STAT3-siRNA对Hela细胞具有特异性细胞毒性的原因所在。
作为一种可电离阳离子脂质,LKA可以用于构建脂质体用于siRNA递送,在细胞层面实现基因沉默,在核酸疗法中具有潜力。
RNA interference in the era of nucleic acid therapeutics
[J]. Nat Biotechnol, 2024, 42(3): 394-405. https://doi.org/10.1038/s41587-023-02105-y.RNA interference: biology, mechanism, and applications
[J]. Microbiol Mol Biol Rev, 2003, 67(4): 657-685. https://doi.org/10. 1128/MMBR.67.4.657-685.2003.Revealing the world of RNA interference
[J]. Nature, 2004, 431(7006): 338-342. https://doi.org/10. 1038/nature02872.Delivery of nucleic acid therapeutics for cancer immunotherapy
[J]. Med Drug Discov, 2020, 6: 100023. https://doi.org/10.1016/j.medidd.2020.100023.Recent advances in siRNA delivery mediated by lipid-based nanoparticles
[J]. Adv Drug Deliv Rev, 2020, 154/155: 64-78. https://doi.org/10.1016/j.addr. 2020.07.022.Therapeutic in vivo delivery of gene editing agents
[J]. Cell, 2022, 185(15): 2806-2827. https://doi.org/10.1016/j.cell.2022.03.045.An ionizable lipid toolbox for RNA delivery
[J]. Nat Commun, 2021, 12(1): 7233. https://doi. org/10.1038/s41467-021-27493-0.Gene therapy on the move
[J]. Nature, 1991, 354(6353): 429. https://doi.org/10.1038/354429a0.Next-generation lipids in RNA interference therapeutics
[J]. ACS Nano, 2017, 11(8): 7572-7586. https://doi.org/10.1021/acsnano.7b04734.Chemistry of lipid nanoparticles for RNA delivery
[J]. Acc Chem Res, 2022, 55(1): 2-12. https://doi.org/10.1021/acs.accounts.1c00544.pH-sensitive, tail-modified, ester-linked ionizable cationic lipids for gene delivery
[J]. Biomater Adv, 2022, 139: 212984. https://doi.org/10.1016/j.bioadv.2022. 212984.Cytosolic delivery of nucleic acids: the case of ionizable lipid nanoparticles
[J/OL]. Bioeng Transl Med, 2021, 6(2): e10213[Optimization of lipid nanoparticles for the delivery of nebulized therapeutic mRNA to the lungs
[J]. Nat Biomed Eng, 2021, 5(9): 1059-1068. https://doi.org/10.1038/s41551-021-00786-x.Rapamycin targets STAT3 and impacts c-Myc to suppress tumor growth
[J/OL]. Cell Chem Biol, 2022, 29(3): 373-385.e6[Dienogest attenuates STAT3 activation in ovarian endometriotic cysts
[J]. Eur J Obstet Gynecol Reprod Biol, 2024, 294: 217-221. https://doi.org/10. 1016/j.ejogrb.2024.01.013.Hispolon methyl ether, a hispolon analog, suppresses the SRC/STAT3/survivin signaling axis to induce cytotoxicity in human urinary bladder transitional carcinoma cell lines
[J]. Int J Mol Sci, 2022, 24(1): 138. https://doi.org/10.3390/ijms24010138.Targeting STAT3 signaling pathway in colorectal cancer
[J]. Biomedicines, 2021, 9(8): 1016. https://doi.org/10.3390/biomedicines9081016.Current status of nucleic acid therapy and its new progress in cancer treatment
[J]. Int Immunopharmacol, 2024, 142(Advances in modification and delivery of nucleic acid drugs
[J]. Zhejiang Da Xue Xue Bao Yi Xue Ban, 2023, 52(4): 417-428. https://doi.org/10.3724/zdxbyxb- 2023-0130.Lipid nanoparticle systems for enabling gene therapies
[J]. Mol Ther, 2017, 25(7): 1467-1475. https://doi. org/10.1016/j.ymthe.2017.03.013.Cationic liposomes carrying siRNA: impact of lipid composition on physicochemical properties, cytotoxicity and endosomal escape
[J]. Nanomaterials, 2018, 8(5): 270. https://doi.org/10.3390/nano8050270.Novel carbamate-linked quaternary ammonium lipids containing unsaturated hydrophobic chains for gene delivery
[J]. Bioorg Med Chem, 2018, 26(12): 3535-3540. https://doi.org/10.1016/j.bmc.2018.05.029.Temperature-sensitive lipid-coated carbon nanotubes for synergistic photothermal therapy and gene therapy
[J]. ACS Nano, 2021, 15(4): 6517-6529. https://doi.org/10.1021/acsnano.0c08790.Solid lipid nanoparticles as efficient drug and gene delivery systems: recent breakthroughs
[J]. Adv Pharm Bull, 2015, 5(2): 151-159. https://doi.org/10.15171/apb.2015.022.In vitro anticancer activity of Nε-acyl lysine methyl ester through folate receptor targeted liposomes
[J]. J Drug Deliv Sci Technol, 2021, 63: 102503. https://doi.org/10.1016/j.jddst.2021.102503.Cancer cell metabolism: Warburg and beyond
[J]. Cell, 2008, 134(5): 703-707. https://doi.org/10.1016/j. cell.2008.08.021.Membrane-destabilizing activity of pH-responsive cationic lysine-based surfactants: role of charge position and alkyl chain length
[J]. Amino Acids, 2012, 43(3): 1203-1215. https://doi.org/10. 1007/s00726-011-1176-8.作者声称无任何利益冲突。
胡敦, 邹俊娜, 聂盛丹, 王艳, 王珊. 一种可电离阳离子脂质构建脂质体用于siRNA递送的体外研究[J]. 中南大学学报(医学版), 2024, 49(10): 1591-1600. DOI:10.11817/j.issn.1672-7347.2024.230247
HU Dun, ZOU Junna, NIE Shengdan, WANG Yan, WANG Shan. In vitro study of siRNA delivery mediated by an ionizable cationic lipid constructing liposome[J]. Journal of Central South University. Medical Science, 2024, 49(10): 1591-1600. DOI:10.11817/j.issn.1672-7347.2024.230247
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024101591.pdf
http://dx.chinadoi.cn/

