宫颈胃型腺癌(gastric-type endocervical adeno-carcinoma,GAS)是一种特殊类型的宫颈腺癌,与高危型人乳头瘤病毒(human papillomavirus,HPV)感染无相关性,临床上非常少见。部分临床医师对此类疾病认识不足,早期诊断困难,容易漏诊、误诊,且此类疾病侵袭性强、易复发转移,患者预后差[1-4]。因此,本研究通过回顾性分析21例GAS患者的临床资料,探讨其临床特点、诊断、治疗及预后,总结相关经验,以提高对早期病变的识别能力。
对象与方法
对象
收集中南大学湘雅三医院妇科2016年4月至2023年2月收治的21例GAS患者的临床资料,包括年龄、临床表现、HPV/薄层液基细胞学检查(thin-prep cytology test,TCT)结果、肿瘤标志物、影像学检查、诊断方式、国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)(2018)分期、病理检查结果、免疫组织化学检查结果、治疗情况等。纳入标准:病理检查联合免疫组织化学诊断为GAS。排除标准:临床资料不完整;随访信息不可靠。本研究获得中南大学湘雅三医院伦理委员会批准(审批号:快23775)。
随访
通过门诊、住院及电话咨询等方式对患者进行随访,随访起始时间为患者接受手术治疗的时间,随访截至2023年5月。疾病无进展生存时间(disease-free survival,DFS)为手术日至复发或随访截止日期,总生存期(overall survival,OS)为手术日至死亡或随访截止日期。
统计学处理
采用SPSS 26.0及GraphPad Prism10.1.0软件进行统计学分析,计数资料以率表示,比较采用χ2检验,计量资料以均数±标准差(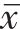
结 果
临床特点
患者年龄18~67(48.4±12.0)岁,其中无性生活者2例,绝经后妇女7例,子宫次全切除术后1例。首发症状为大量阴道流液13例(61.9%),包括透明黏液状5例,透明水样8例,其中1例有多年咳嗽溢尿史;阴道排脓1例(4.8%);绝经后阴道流血3例(14.3%);同房出血2例(9.5%);经期延长1例(4.8%);下腹坠胀1例(4.8%)。妇科检查(无性生活者宫腔镜所见)宫颈肥大13例,正常大小1例,结节状肿块外观7例,菜花样肿块外观3例,可见异形血管2例,糜烂8例,光滑2例,质硬11例。
实验室及影像学检查
除了2例无性生活者,其余患者均行TCT、HPV检测。HPV阴性17例,阳性2例(16型、未分型);TCT阴性13例,意义未明的非典型鳞状细胞(atypical squamous cells of undetermined significance,ASC-US)2例,不能明确意义的非典型腺细胞(atypical glandular cells not otherwise specified,AGC-NOS)1例,不能排除高度鳞状上皮内瘤变的非典型鳞状细胞(atypical squamous cells: cannot exclude high-grade squamous intraepithelial lesion,ASC-H)1例,非典型腺细胞(atypical glandular cells,AGC)2例。术前肿瘤标志物CA199升高6例(6/12)、CA125升高4例(4/21)、人附睾蛋白4(human epididymal protein 4,HE4)升高3例(3/13)、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC)升高1例(1/19),甲胎蛋白(alpha fetoprotein,AFP)(12例)、癌胚抗原(carcino-embryonic antigen,CEA)(20例)、CA153(9例)均正常。21例患者术前均行B超检查,其中探及宫颈不均质高回声团5例,宫颈低回声团6例,宫颈混合回声团2例,宫颈多发无回声区7例,宫颈探及丰富血流信号7例,子宫内膜回声不均匀2例,宫腔液暗区10例(大量液暗区3例),考虑宫颈恶性肿瘤9例,子宫内膜恶性肿瘤1例。行盆腔MRI(图1)检查者17例,其中提示宫颈体积增大11例,宫颈等T1稍长T2信号灶6例,弥散加权成像(diffusion weighted imaging,DWI)序列病灶呈不均匀高信号11例,相应表观弥散系数(apparent diffusion coefficient,ADC)图低信号11例,增强扫描呈不均匀强化8例,宫颈多发囊状长T2信号灶7例,宫腔积液8例,考虑宫颈恶性肿瘤9例,子宫内膜恶性肿瘤2例。行盆腔CT检查者9例,提示宫颈体积增大5例(其中团状/结节状肿块2例),宫腔积液4例,考虑宫颈恶性肿瘤7例。
术前诊断方式
行病理检查1次者9例,2次者7例,3次者5例,确诊率为61.9%(13/21)。1次病理检查:阴道镜活检6例,宫腔镜检+宫颈管组织电切活检3例,确诊率为33.3%(3/9)。2次病理检查:无损伤处女膜宫腔镜检2次1例,阴道镜活检2次1例,阴道镜活检未确诊行宫腔镜检+分段诊刮1例,阴道镜活检未确诊行残余宫颈及肿块切除1例,宫腔镜检转阴道镜活检2例,宫颈镜检+分段诊刮+宫颈锥切后筋膜外全子宫切除1例,确诊率为71.4%(5/7)。3次病理检查:宫腔镜检及分段诊刮、阴道镜活检均阴性再行宫颈leep术1例,宫腔镜检+分段诊刮、阴道镜活检均阴性再行阴道镜活检1例,宫颈管搔刮、宫腔镜检及颈管组织电切未确诊再行宫颈锥切1例,阴道镜活检阴性行宫腔镜检+分段诊刮+宫颈管组织电切,病理结果未确诊再行B超引导下宫颈后方肿块穿刺活检1例,宫腔镜检阴性后行阴道镜活检仍阴性再行宫腔镜检+宫颈肿块电切1例,确诊率为100%(5/5)(表1)。
| 编号 | 年龄/岁 | 首发症状 | 病程 | HPV | TCT | 临床分期 | 病理 分期 | 诊断方式 | 肿瘤最长径/cm | 治疗方式 | DFS/ 月 | OS/ 月 | 结局 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 29 | 阴道流液 | 1年 | ⅡB | ⅢC2p | (3) | 7.0 | 根治性手术+同步放化疗 | 10 | 22 | 带瘤生存 | ||
| 2 | 30 | 阴道流液 | 5+个月 | 阴性 | 阴性 | ⅢC1p | (4)(1)(9) | 4.5 | 根治性手术+同步放化疗 | 27 | 27 | 无瘤生存 | |
| 3 | 18 | 阴道流液 | 5个月 | ⅢB | ⅢC2p | (3)(3) | 2.5 | 宫颈癌动脉造影、灌注化疗、栓塞术+新辅助化疗+根治性手术(保留右侧 卵巢)+化疗 | 6 | 10 | 死亡 | ||
| 4 | 42 | 阴道流液 | 1+年 | 阴性 | ASC-US | ⅡB | ⅡB | (1)(1) | 7.5 | 根治性手术+同步放化疗 | 6 | 17 | 死亡 |
| 5 | 63 | 绝经后 阴道流液 | 5年 | 阴性 | ASC-US | ⅡB | ⅢC1p | (4)(1)(1) | 4.0 | 新辅助化疗+根治性手术+同步放化疗 | 5 | 9 | 死亡 |
| 6 | 61 | 下腹坠胀 | 3+年 | 阴性 | AGC-NOS | ⅢC1p | (1)(8) | 7.0 | 根治性手术+同步放化疗 | 8 | 13 | 死亡 | |
| 7 | 43 | 阴道流液 | 3个月 | 阴性 | 阴性 | ⅠB1 | ⅠB1 | (2)(5)(10) | 0.8 | 根治性手术+化疗 | 22 | 22 | 无瘤生存 |
| 8 | 51 | 阴道流液 | 4个月 | 阴性 | 阴性 | ⅠB2 | IB3 | (5) | 3.0 | 根治性手术+化疗 | 24 | 24 | 无瘤生存 |
| 9 | 42 | 阴道排脓 | 1+年 | 阴性 | 阴性 | ⅠB1 | ⅠB1 | (1)(6)(12) | 2.7 | 根治性手术+化疗 | 24 | 24 | 失访 |
| 10 | 50 | 阴道流液 | 1年 | 阴性 | 阴性 | ⅠB1 | ⅠB1 | (11)(14) | 1.5 | 根治性手术 | 10 | 10 | 无瘤生存 |
| 11 | 44 | 同房出血 | 6个月 | 阴性 | 阴性 | ⅡA2 | ⅢC2p | (1) | 4.0 | 新辅助化疗+根治性手术+同步放化疗 | 13 | 13 | 无瘤生存 |
| 12 | 63 | 绝经后阴道流液 | 1+年 | 阴性 | 阴性 | ⅡA1 | ⅢC1p | (4)(1)(5) | 2.9 | 根治性手术+同步放化疗+补充化疗 | 3.5 | 3.5 | 无瘤生存 |
| 13 | 48 | 阴道流液 | 1+年 | 阴性 | AGC | ⅠB3 | ⅢC1p | (4)(1) | 2.5 | 根治性手术+同步放化疗 | 13.5 | 13.5 | 无瘤生存 |
| 14 | 49 | 同房出血 | 2个月 | 阴性 | AGC | ⅡA1 | ⅡB | (1) | 2.2 | 根治性手术+同步放化疗 | 8.5 | 8.5 | 无瘤生存 |
| 15 | 44 | 经期延长 | 3个月 | 阴性 | 阴性 | ⅡA2 | ⅡA2 | (1) | 4.1 | 新辅助化疗+根治性手术+同步放化疗 | 28 | 28 | 无瘤生存 |
| 编号 | 年龄/岁 | 首发症状 | 病程 | HPV | TCT | 临床分期 | 病理 分期 | 诊断方式 | 肿瘤最大径线/cm | 治疗方式 | DFS/ 月 | OS/ 月 | 结局 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 16 | 53 | 阴道流液 | 2年 | 阴性 | 阴性 | ⅠB2 | ⅠB2 | (7) | 3.8 | 根治性手术+同步放化疗 | 12 | 12 | 无瘤生存 |
| 17 | 52 | 阴道流血 | 20 d | 阴性 | 阴性 | ⅡA1 | ⅡA1 | (1) | 3.2 | 根治性手术+同步放化疗 | 9 | 9 | 无瘤生存 |
| 18 | 67 | 绝经后阴道流血 | 1个月 | 阴性 | 阴性 | ⅡA1 | ⅢC1p | (1) | 4.2 | 根治性手术+同步放化疗 | 10 | 12 | 死亡 |
| 19 | 56 | 绝经后阴道流血 | 20 d | 阴性 | 阴性 | ⅠB2 | ⅢC1p | (4)(1) | 2.5 | 根治性手术+化疗3次+放疗2次 | 20 | 20 | 无瘤生存 |
| 20 | 62 | 绝经后阴道流液 | 6个月 | 16型 | ASC-H | ⅡA2 | ⅢC2p | (1) | 5.0 | 新辅助化疗+根治性手术+同步放化疗 | 14 | 23 | 死亡 |
| 21 | 49 | 阴道流液 | 1年 | 未分型 | 阴性 | ⅠB3 | ⅠB3 | (1)(13) | 7.0 | 根治性手术+化疗 | 24 | 24 | 无瘤生存 |
治疗方式
所有患者均行手术治疗,行广泛性全子宫+双侧附件+盆腔淋巴结切除术19例(包括筋膜外子宫切除术后因病检升级补行广泛切除1例),行广泛性全子宫+左侧附件+右侧输卵管+盆腔淋巴结切除术1例,子宫次全切除术后患者行广泛性残余宫颈切除+双侧附件+盆腔淋巴结切除术1例,其中同时行腹主动脉旁淋巴结切除15例,大网膜切除8例,阑尾切除7例,保留右侧卵巢1例。术前宫颈癌动脉造影+灌注化学治疗(以下简称“化疗”)+栓塞术1例,新辅助化疗5例[PT(顺铂+紫杉醇类)/TC(紫杉醇类+环磷酰胺)方案1~2程],术后单纯性辅助化疗5例[PT/PF(顺铂+5-氟尿嘧啶)/DP(多西他赛+顺铂)方案1~5程],辅助同步放射治疗+化疗15例(铂类每周单药/PT方案化疗2~5程,盆腔区域放疗±阴道后装治疗2~25次,其中完成足疗程者12例),未行辅助治疗1例。
分期
采用FIGO(2018)分期标准,临床分期:ⅠB1期3例,ⅠB2期3例,ⅠB3期2例,ⅡA1期4例,ⅡA2期3例,ⅡB期3例,ⅢB期1例,未分期2例。术后病理分期:ⅠB1期3例,ⅠB2期1例,ⅠB3期2例,ⅡA1期1例,ⅡA2期1例,ⅡB期2例,ⅢC1p期7例,ⅢC2p期4例。
病理及免疫组织化学检查
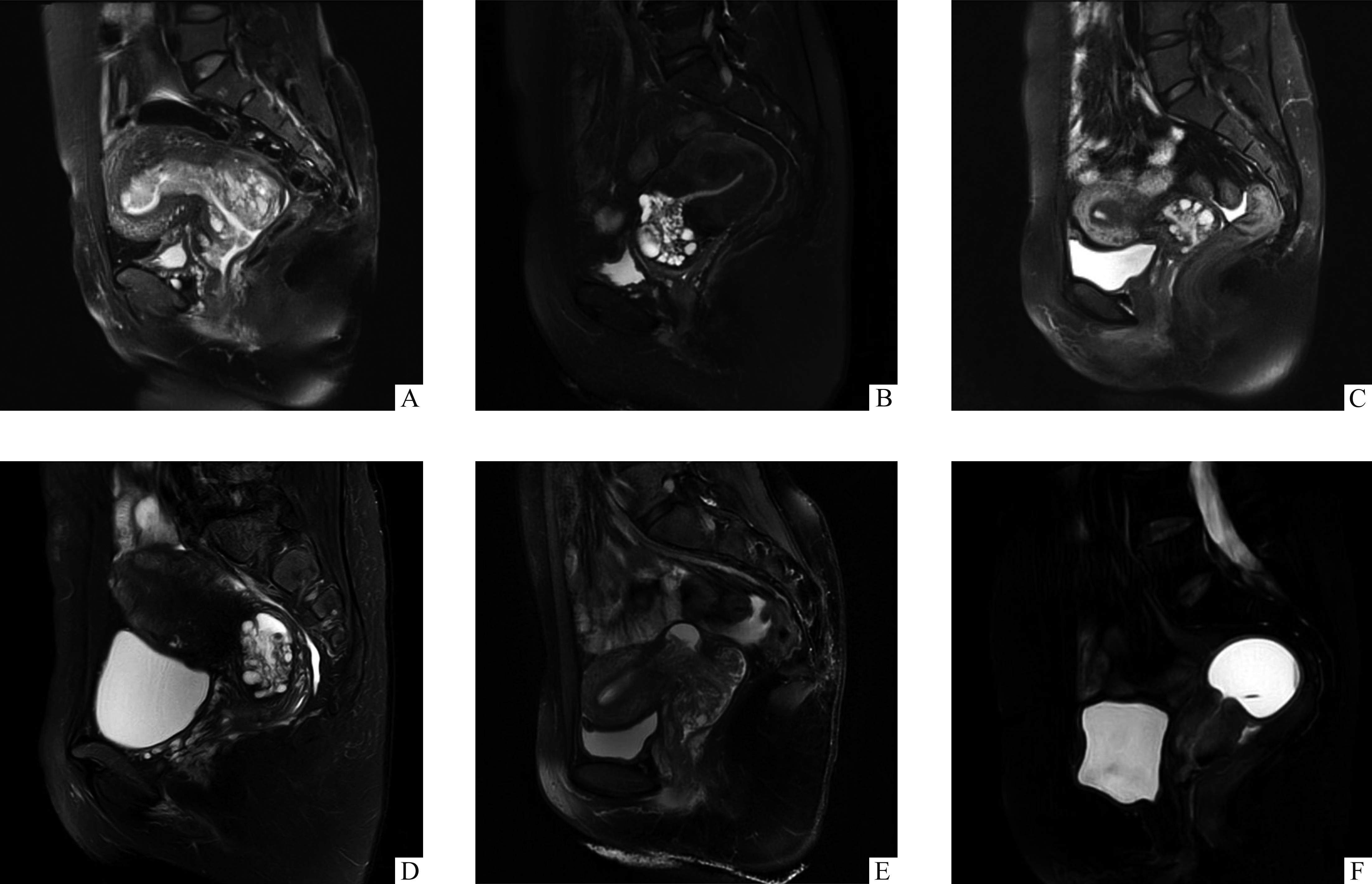
肿瘤浸润深度/最长径为0.8~7.5 cm,<4 cm者11例,≥4 cm者10例。术后病理诊断宫颈胃型腺癌21例,其中非典型性叶状增生伴局灶胃型腺癌1例,微偏腺癌(minimal deviation adenocarcinoma,MDA)7例,MDA伴部分肠型黏液腺癌1例、伴区域普通型腺癌1例,非典型性叶状增生伴局灶MDA 1例。宫旁浸润7例(33.3%),阴道残端癌残留2例(9.5%),深间质浸润(浸润深度≥1/2)19例(90.5%),淋巴管血管间隙浸润15例(71.4%),神经侵犯9例(42.9%),盆腔淋巴结转移11例(52.4%),腹主动脉旁淋巴结转移4例(19.0%),侵犯阴道上段11例(52.4%)、宫体肌层15例(71.4%)、侵犯子宫内膜、输卵管、卵巢各4例(均19.0%)、膀胱腹膜返折、盆壁腹膜转移各1例(均4.8%)、淋巴结周围脂肪组织2例(9.5%)、大网膜1例(4.8%),阑尾0例(0%)。卵巢黏液性囊腺瘤2例(9.5%),一侧/双侧卵巢滤泡囊肿9例(42.9%)。
免疫组织和化学检测中黏蛋白6(mucin 6,MUC6)阳性率88.2%(15/17);细胞角蛋白(cytokeratin,CK)7阳性率100%(16/16),其中强阳性率56.3%(9/16);CK20阳性率20%(3/15);尾型同盒转录子-2(caudal type homeobox 2,CDX-2)阳性率20%(2/10);CEA弱阳性率70.6%(12/17);SATB2阳性率0%(0/8);P16弱阳性率33.3%(7/21)例;P53阳性率30%(6/20)、野生型40%(8/20)、错义突变20%(4/20);雌激素受体(estrogen receptor,ER)弱阳性率12.5%(2/16);孕激素受体(progesterone receptor,PR)弱阳性率6.3%(1/16);Ki-67 2%~10%阳性率33.3%(7/21)、15%~30%阳性率38.1%(8/21)、40%~60%阳性率28.6%(6/21)(图2)。
生存预后情况
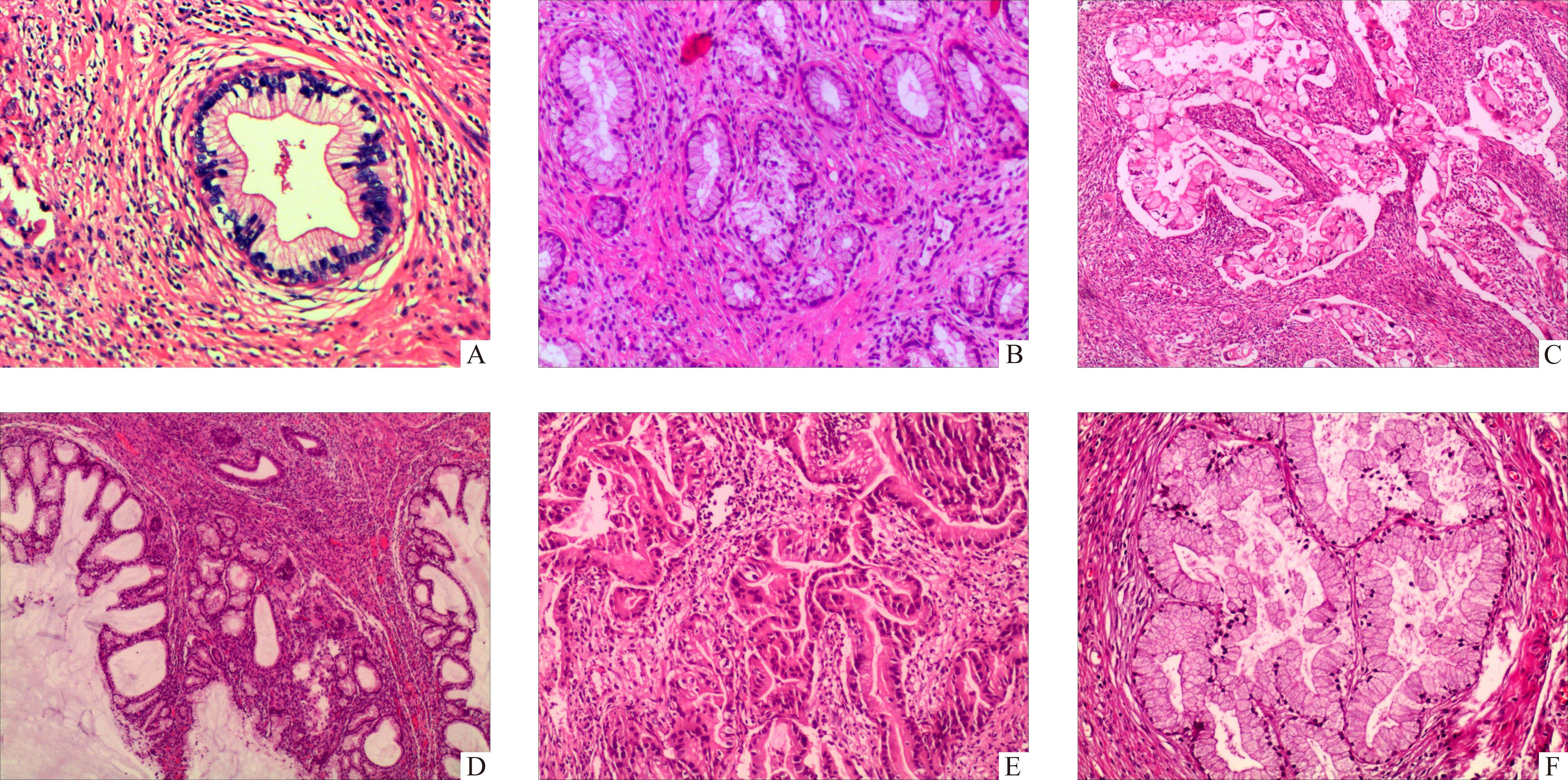
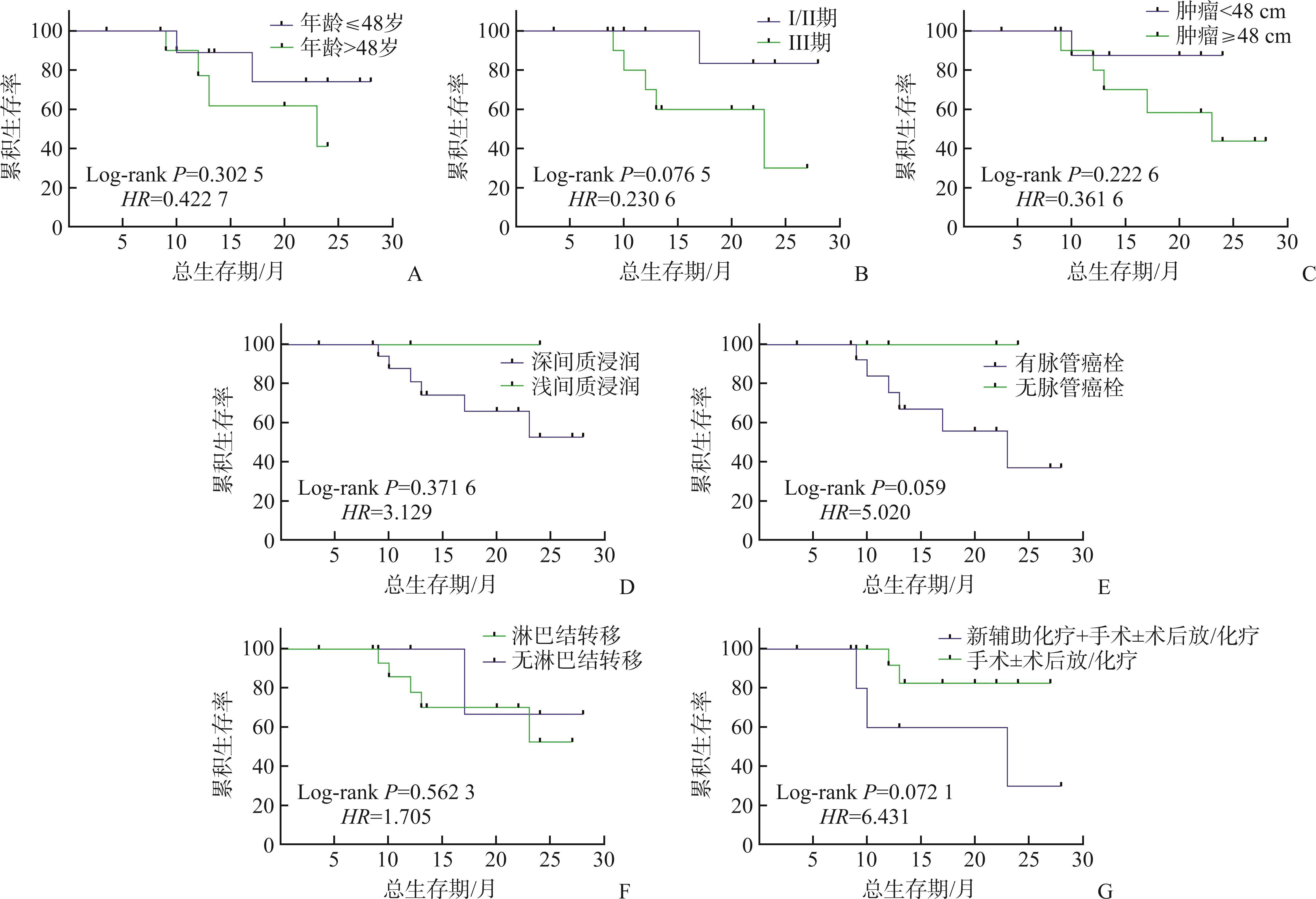
20例患者完成随访,1例术后2年失访。随访时间3.5~28.0(中位数13.5)个月,13例未复发,7例复发(6例死亡,1例带瘤生存)。1例术后10个月出现阴道残端复发;1例术后6个月出现右侧卵巢、腹膜后、左侧腹股沟淋巴结转移,术后10个月死亡;1例术后6个月出现输尿管、肠道转移,术后17个月死亡;1例术后5个月出现腹膜、网膜、腹壁、右侧输尿管转移,术后9个月死亡;1例术后8个月出现输尿管和肠道转移,术后13个月死亡;1例术后10个月出现肠道转移,术后12个月死亡;1例术后14个月出现阴道残端、腹膜后及淋巴结、左侧输尿管、膀胱等复发转移,术后23个月死亡。本组患者OS为3.5~28.0(22.7±1.8)个月,DFS为3.5~28.0(20.4±2.3)个月,1年、2年累积总生存率分别为83.2%和57.6%(图3)。本组患者OS与年龄、肿瘤分期、肿瘤大小、间质浸润深度、淋巴管血管间隙浸润、淋巴结转移、治疗方式均无关(均P>0.05,图4)。Cox回归分析显示年龄、病理分期、肿瘤大小、间质浸润深度、淋巴管血管间隙浸润、神经侵犯、淋巴结转移与患者的DFS、OS均无关(均P>0.05,表2)。
| 变量 | DFS | OS | ||
|---|---|---|---|---|
| HR(95% CI) | P | HR(95% CI) | P | |
| 年龄 | 0.558(0.115~2.707) | 0.469 | 0.255(0.033~1.943) | 0.187 |
| 病理分期 | 0.709(0.072~6.966) | 0.768 | 1.251(0.095~16.495) | 0.865 |
| 肿瘤大小 | 0.327(0.036~2.945) | 0.319 | 0.676(0.066~6.904) | 0.741 |
| 间质浸润深度 | 0.382(0.000~) | 0.999 | 0.333(0.000~) | 0.999 |
| 淋巴管血管间隙浸润 | 0.000(0.000~) | 0.975 | 0.000(0.000~) | 0.974 |
| 神经侵犯 | 0.875(0.177~4.337) | 0.870 | 0.859(0.143~5.165) | 0.868 |
讨 论
随着宫颈HPV疫苗的普及,HPV相关性宫颈癌的发病率逐渐下降,而非HPV相关性宫颈癌的发病率有相对上升趋势[5]。GAS作为非HPV相关性宫颈癌的常见类型,在宫颈腺癌的占比由1%~3%逐渐上升至10%~25%[6-7]。目前其发病原因尚未明确,可能由叶状宫颈腺体增生(lobular endocervical glandular hyperplasia,LEGH)、非典型LEGH、胃型原位腺癌等前趋病变发展而来[8]。研究[9-10]报道一部分GAS患者合并Peutz-Jeghers综合征、卵巢环状小管性索间质肿瘤、卵巢黏液性肿瘤等疾病,本组患者病理结果提示非典型LEGH 2例,卵巢黏液性囊腺瘤2例,卵巢滤泡囊肿9例,GAS的发病可能与这些疾病的发生、发展相关,具体发病机制有待探究。
GAS早期诊断困难,容易漏诊、误诊,主要原因在于:1)GAS发病率低,临床表现缺乏特异性,首发症状多表现为大量水样或黏液样阴道流液,少部分出现与常见宫颈癌类似的症状,如绝经后阴道流血、同房后出血、下腹胀痛等[11],另一部分还可出现反复阴道排脓、宫腔积液等,有盆底功能障碍的患者出现压力性尿失禁,易与阴道水样流液混淆,未能引起重视,导致病情发展。2)GAS的病灶多位于宫颈上段、宫颈内腺体的深部,宫颈局部通常无明显外生性肿块,多描述为“桶状”宫颈[1, 12]。本组患者宫颈多表现为肥大、糜烂,部分可见异型血管、肿块样外观,可能与肿瘤明显侵犯、分期较晚有关,部分早期患者宫颈光滑、病灶小,无明显“桶状”宫颈表现,阴道镜活检确诊率低。3)GAS在传统宫颈癌“三阶梯”筛查中受限,大部分患者HPV及TCT筛查阴性,阴道镜转诊率低。本组患者HPV阴性率达89.47%,TCT阴性率达68.42%,小部分TCT筛查提示ASC-US、AG-NOS、ASC-H或AGC。4)无性生活女性的筛查更为困难[13],常采取无创性检查,缺乏妇科检查、HPV及TCT筛查的诊断证据,如肛查或者影像学提示有明显病灶时,无损伤处女膜宫腔镜可能是一种筛查选择,但宫腔镜检查费用高,无损伤处女膜宫腔镜对于妇科医师的操作技术要求高。
对于HPV/TCT结果阴性但有明显的阴道流液、流血症状时,可借助影像学来进一步判断。本组患者大多数B超检查提示宫颈有不均质高回声、低回声及混合回声等异常回声团;MRI检查提示宫颈等T1稍长T2信号灶,DWI序列病灶呈不均匀高信号,相应ADC图低信号,增强扫描呈不均匀强化。CT也是常规的辅助检查,但B超和MRI对于宫颈病变、宫腔积液及宫颈多发囊肿的检出率更高。影像学上仍需与其他类型宫颈癌、宫颈癌侵犯宫内膜、子宫内膜病变、宫颈纳氏囊肿、宫颈粘连狭窄导致宫腔积液等相鉴别。蒋文燕等[14]认为富含大量黏液腺形成的囊状回声是腺癌独有的特点。钱亭等[15]研究报道了实性成分为主的GAS在MRI上通常表现等T1稍长T2信号,DWI呈高信号,增强扫描明显强化;以囊性成分为主的T2为高信号,DWI未见明显高信号。刘明明等[16]研究发现GAS在T1上均表现为等信号,T2及压脂(fat suppression,FS)T2上囊实性肿块的囊呈弥漫或簇状分布,大小不一,多位于深肌层,小囊表现为较规则的圆形,大囊形态不规则且囊壁不光滑,囊与囊之间可见等或稍高信号不规则条状或颗粒状分隔。Takatsu等[17] 及Ohya等[18]研究发现GAS在MRI上呈现“宇宙征”,即病灶通常位于子宫颈中上段,可表现为中央较小的囊性或实性病灶,周围包绕着较大的囊肿。
血清肿瘤标志物也具有诊断价值,本组患者CA199、CA125的阳性率较高,AFP、CEA、CA153均正常。文献[19-20]报道约一半以上的GAS患者CA199升高,约1/3有CA125升高,而CA125的升高可能提示有盆腹腔转移。监测CA199、CA125的变化或许可作为评估治疗效果或复发的参考。
由于GAS病灶部位较隐匿,取材时不易取到病灶组织,增加了诊断的难度。本组患者术前病检1次者9例,2次者7例,3次者5例,1次病检者多存在宫颈明显肿瘤样外观,通过阴道镜或宫腔镜下颈管组织电切活检诊断,但确诊率不高,原因在于获取组织少,未能准确分型,仅可判断为宫颈恶性肿瘤;2、3次病检者多为早期病变、宫颈病变较深、活检取材少,考虑良性病变等需多次取材,进行多点、宫颈大块病灶切除送检,采用宫颈leep术、锥切、经B超引导行肿块穿刺等可提高确诊率,但仍有2例患者出现锥切病理漏诊,导致手术切除范围不够。另外,对于不能通过窥阴器行宫颈暴露的无性生活女性,可采用无损伤处女膜宫腔镜检来明确病变情况。研究[20]报道单次子宫颈活检的诊断率为40%,多次活检未能进一步提高诊断率,而联合子宫颈锥切、诊断性刮宫可提高诊断率至50%。临床上建议采用宫颈和宫颈管的深活检(>5 mm)或宫颈锥切来提高检出率,也有学者建议采用深度>8 mm的活检和锥切来明确诊断,当腺体浸润宫颈上皮>8 mm时应警惕GAS[21]。
病理检查是诊断的金标准,在常规病理检查中分化较好的GAS难以与良性病变区分,需联合免疫组织化学检测,减少或避免病理上的漏诊、误诊。MUC6和HIK1083是胃型黏液的免疫标志物[22],两者在GAS中阳性率较高,但灵敏度一般,HIK1083的特异度较MUC6高,据报道MUC6的灵敏度和特异度分别为0.51、0.74,HIK1083分别为0.64、0.94[23]。CK7、CDX2、CK20和CEA在GAS中多呈局灶阳性或弥漫阳性,P16一般呈阴性或局灶阳性[24];约一半的患者存在p53突变型表达[25];ER、PR多为阴性,Ki-67阳性率通常<40%[11]。本组所有患者均行免疫组织化学检测,其中MUC6阳性率88.2%,CK7阳性率100%,P16、CK20、CDX-2、CEA、ER、PR阳性率较低;p53约60%为野生型、错义突变表达;Ki-67 2%~10%阳性占33.3%、15%~30%阳性占38.1%、40%~60%阳性占28.6%,与文献[11, 23-25]报道基本相符。
GAS目前没有统一的治疗指南,2023年中国专家共识[11]提出早期患者以手术治疗为主,术后辅助放射治疗、化疗、靶向治疗,手术范围推荐为广泛子宫切除+盆腔淋巴结切除±腹主动脉旁淋巴结切除术,同时建议切除双附件、大网膜、阑尾及盆腹腔内转移病变。虽然年轻患者有保留生育功能和卵巢的需求,但即使对早期病变,也不建议保留[26]。GAS的侵袭性强,据报道GAS的卵巢转移率约25.5%[27]。本组1例年轻患者强烈要求保留肉眼无明显病变的右侧卵巢,术后6个月影像学检查提示卵巢转移。本组患者大多数伴有宫旁浸润、淋巴结转移、淋巴管血管间隙浸润、神经侵犯、卵巢转移、周围脏器转移等。因此除了切除一切肉眼可见病灶外,有高危转移风险的周围组织也应尽可能切除。
GAS确诊时多达晚期,术后中高危因素多,对于普通宫颈腺癌常采用“四因素模型”标准进行辅助放射治疗和化疗[28]。专家认为GAS恶性程度高,建议适当放宽术后放射治疗和化疗指征[11]。本组约71.4%的患者术后辅助同步放射治疗和化疗,约23.8%的患者术后单纯性辅助化疗。但GAS对放射治疗和化疗的敏感性差[29-30]。Kojima等[31]采用多西他赛和卡铂联合新辅助化疗研究GAS与普通型宫颈腺癌的药物敏感性,发现GAS的有效率明显低于普通型宫颈腺癌。GAS易复发转移、预后差,研究[1]报道GAS在9年内复发率约40%,而普通型宫颈腺癌为14.6%。本组约33.3%的患者术后6~14个月即出现盆腹腔多发组织脏器转移。Karamurzin等[6]发现GAS的转移部位包括淋巴结、附件、网膜、肠、腹膜、膈肌、腹壁、膀胱、阴道、阑尾和脑,GAS患者5年的生存率为42%,而普通型宫颈腺癌患者的5年生存率为91%。本研究没有与普通腺癌及鳞癌进行比较,Cox回归分析未得到有统计学意义的指标,事实上肿瘤性质—胃型腺癌本身就是DFS和OS的主要危险因素。
综上所述,GAS的发病与高危型HPV感染不相关,临床症状缺乏特异性,病灶较深导致取材困难,常规筛查和活检阳性率低。临床上对于HPV阴性但有明显阴道流液者,应警惕GAS的可能,可采用多次多点、获得较深组织的活检方式并结合影像学检查尽早明确诊断。
Analysis of gastric-type mucinous carcinoma of the uterine cervix—An aggressive tumor with a poor prognosis: a multi-institutional study
[J]. Gynecol Oncol, 2019, 153(1): 13-19. https://doi.org/10.1016/j.ygyno.2019.01.022.Gastric-type mucinous carcinoma of the cervix and its precursors—historical overview
[J]. Histopathology, 2020, 76(1): 102-111. https://doi.org/10.1111/his.13993.Gastric-type mucinous endocervical adenocarcinomas: a case report and literature review
[J]. Front Cell Infect Microbiol, 2022, 12: 917009. https://doi.org/10. 3389/fcimb.2022.917009.Programmed death-ligand 1 expression in human papillomavirus-independent cervical adenocarcinoma and its prognostic significance
[J]. Histopathology, 2022, 80(2): 338-347. https://doi.org/10.1111/his.14552.重视子宫颈胃型腺癌,提高精准诊治水平
[J]. 中国实用妇科与产科杂志, 2021, 37(1): 25-28. https://doi.org/10.19538/j.fk2021010106.Gastric-type endocervical adenocarcinoma: an aggressive tumor with unusual metastatic patterns and poor prognosis
[J]. Am J Surg Pathol, 2015, 39(11): 1449-1457. https://doi.org/10.1097/PAS. 0000000000000532.Minimal deviation adenocarcinoma of the uterine cervix
[J]. Int J Gynaecol Obstet, 2010, 110(2): 89-92. https://doi.org/10.1016/j.ijgo.2010.03.016.Cervical adenocarcinoma: integration of HPV status, pattern of invasion, morphology and molecular markers into classification
[J]. Histopathology, 2020, 76(1): 112-127. https://doi.org/10.1111/his.13995.Endocervical glandular lesions exhibiting gastric differentiation: an emerging spectrum of benign, premalignant, and malignant lesions
[J]. Adv Anat Pathol, 2013, 20(4): 227-237. https://doi.org/10.1097/PAP. 0b013e31829c2d66.Minimal deviation adenocarcinoma of the cervix and tumorlets of sex-cord stromal tumor with annular tubules of the ovary in Peutz-Jeghers syndrome
[J]. J Gynecol Oncol, 2013, 24(1): 92-95. https://doi.org/10.3802/jgo.2013.24.1.92.子宫颈胃型腺癌临床诊治中国专家共识(2023年版)
[J]. 中国实用妇科与产科杂志, 2023, 39(6): 617-625. https://doi.org/10.19538/j.fk2023060111.Gastric-type adenocarcinoma of the cervix: tumor with wide range of histologic appearances
[J]. Adv Anat Pathol, 2019, 26(1): 1-12. https://doi.org/10.1097/PAP.0000000000000216.宫腔镜对未婚阴道斜隔综合征的早期诊断与治疗的临床意义
[J]. 中国妇产科临床杂志, 2010, 11(6): 423-425. https://doi.org/10.3969/j.issn.1672-1861.2010. 06.008.子宫颈胃型腺癌超声表现1例
[J]. 中国超声医学杂志, 2023, 39(6): 721. https://doi.org/10.3969/j.issn.1002-0101.2023.06.035.宫颈胃型腺癌MRI征象与病理对照分析
[J]. 中国医学计算机成像杂志, 2022, 28(6): 616-620. https://doi.org/10.19627/j.cnki.cn31-1700/th.2022.06.007.宫颈胃型黏液腺癌的MRI表现
[J]. 国际医学放射学杂志, 2021, 44(5): 589-592. https://doi.org/10.19300/j.2021.L18511.Preoperative differential diagnosis of minimal deviation adenocarcinoma and lobular endocervical glandular hyperplasia of the uterine cervix: a multicenter study of clinicopathology and magnetic resonance imaging findings
[J]. Int J Gynecol Cancer, 2011, 21(7): 1287-1296. https://doi.org/10.1097/IGC.0b013e31821f746c.Usefulness of the ‘cosmos pattern’ for differentiating between cervical gastric-type mucin-positive lesions and other benign cervical cystic lesions in magnetic resonance images
[J]. J Obstet Gynaecol Res, 2021, 47(2): 745-756. https://doi.org/10.1111/jog.14602.Mucinous adenocarcinoma, gastric type of the uterine cervix: clinical features and HER2 amplification
[J]. Med Mol Morphol, 2019, 52(1): 52-59. https://doi.org/10.1007/s00795-018-0202-2.子宫颈胃型腺癌11例临床分析
[J]. 肿瘤预防与治疗, 2021, 34(5): 431-437. https://doi.org/10.3969/j.issn.1674-0904.2021.宫颈微偏腺癌诊治进展
[J]. 中国实用妇科与产科杂志, 2016, 32(4): 372-375. https://doi.org/10.7504/fk2016030119.Gastric morphology and immunophenotype predict poor outcome in mucinous adenocarcinoma of the uterine cervix
[J]. Am J Surg Pathol, 2007, 31(5): 664-672. https://doi.org/10.1097/01.pas.0000213434.91868.b0.Diagnostic accuracy of HIK1083 and MUC6 as immunohistochemical markers of endocervical gastric-type adenocarcinoma: a systematic review and meta-analysis
[J]. Pathol Res Pract, 2023, 241: 154261. https://doi.org/10.1016/j.prp.2022.154261.A detailed immunohistochemical analysis of a large series of cervical and vaginal gastric-type adenocarcinomas
[J]. Am J Surg Pathol, 2016, 40(5): 636-644. https://doi.org/10.1097/PAS.0000000000000578.Morphologic features of gastric-type cervical adenocarcinoma in small surgical and cytology specimens
[J]. Int J Gynecol Pathol, 2019, 38(3): 263-275. https://doi.org/10.1097/PGP.0000000000000519.Analysis of postoperative adjuvant therapy in 102 patients with gastric-type mucinous carcinoma of the uterine cervix: a multi-institutional study
[J]. Eur J Surg Oncol, 2022, 48(9): 2039-2044. https://doi.org/10. 1016/j.ejso.2022.03.007.Ovarian metastasis by gastric-type endocervical adenocarcinoma: a clinicopathologic description of 12 cases
[J]. Int J Gynecol Pathol, 2022, 41(4): 356-365. https://doi.org/10.1097/PGP.0000000000000815.2022年第1版《NCCN子宫颈癌临床实践指南》解读
[J]. 实用肿瘤杂志, 2022, 37(3): 205-214. https://doi.org/10.13267/j.cnki.syzlzz.2022.034.Biology and treatment of cervical adenocarcinoma
[J]. Chin J Cancer Res, 2016, 28(2): 254-262. https://doi.org/10.21147/j.issn.1000-9604.2016.02.11.Gastric-type adenocarcinoma of the uterine cervix associated with poor response to definitive radiotherapy
[J]. Cancers, 2022, 15(1): 170. https://doi.org/10.3390/cancers15010170.Chemoresistance of gastric-type mucinous carcinoma of the uterine cervix: a study of the Sankai gynecology study group
[J]. Int J Gynecol Cancer, 2018, 28(1): 99-106. https://doi.org/10.1097/IGC.0000000000001145.作者声称无任何利益冲突。
黄宗燕, 李巧芬, 陈佩琳, 向慧敏, 曾向阳, 肖松舒. 宫颈非HPV相关性胃型腺癌的临床特征[J]. 中南大学学报(医学版), 2024, 49(9): 1397-1408. DOI:10.11817/j.issn.1672-7347.2024.230504
HUANG Zongyan, LI Qiaofen, CHEN Peilin, XIANG Huimin, ZENG Xiangyang, XIAO Songshu. Clinical characteristics of non-HPV infection-associated gastric-type endocervical adenocarcinoma[J]. Journal of Central South University. Medical Science, 2024, 49(9): 1397-1408. DOI:10.11817/j.issn.1672-7347.2024.230504
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2024091397.pdf
http://dx.chinadoi.cn/10.11817/j.issn.1672-7347.2024.230504

