近年来,电化学储能技术发展迅速,在便携式电子设备、航空航天、电动汽车等领域的应用极大地便利了人们的生活。锂离子电池(LIBs)由于质量轻、能量密度高和功率密度大的显著优势,已经成为当今主流储能系统的关键组成部分。然而,锂资源分布不均、地壳储量有限和开采难度高等问题突出[1]。因此,研究者们采用地壳丰度高的碱金属离子(如Na+和K+)作为载体,正积极推动其他碱金属离子电池,诸如钠离子电池(SIBs)和钾离子电池(KIBs)的发展和LIBs技术相互补充[2],以抵御区域资源风险,应对大规模储能。
正极材料作为电池的关键组成部分直接决定了电池的能量密度、总成本、使用寿命和安全性能。因此,开发高性能、低成本、环保的正极材料以满足高能量密度和长循环寿命需求,是当前研究的重点[3-5]。目前,各种晶体正极材料已被深入研究(如LiFePO4[6]、LiCoO2[7]、Na3V2(PO4)3[8]、K0.22V2O5[9]等)。同时,许多研究报道了改善正极电化学性能的策略,如独特的结构设计[10]、减小尺寸[11]、原子掺杂[12]和构建异质结构[13]等。尽管这些方法提升了电池的电化学性能,但由于其成本高、工艺复杂、且性能提升有限,仍需开发高效低成本的正极材料储能体系。非晶材料在密度、力学性能、热学性能、电导性等物理和化学性质上与晶体材料存在显著差异,其结构仅在1 nm范围内短程有序排列,这些有序团簇之间是随机链接的(长程无序)[14]。相比晶体正极,非晶正极具有长程无序、短程有序的独特结构,不仅具备较高的电子电导率、较低的离子迁移能垒和优越的电化学可逆性,而且具有良好的热传导和阻燃性,有利于提高储能器件的电化学性能和安全性能[15]。
非晶正极材料在各种电化学储能器件中展现出巨大应用潜力,其性能和储能机理已经受到了广泛研究。尽管已有一些关于非晶材料的综述报道[16-18],但它们并未聚焦于碱金属离子电池的非晶正极材料领域,且近几年新报道了一些极具应用前景的非晶正极材料,因此,有必要对其研究现状进行系统分析。本文述重点综述了碱金属离子电池用非晶正极材料的最新研究进展,总结了非晶正极材料在电化学储能领域的近期发展趋势和重大成就,分析了非晶正极材料的合成方法及电化学性能,并探讨了代表性的先进非晶材料表征技术和非晶结构对各种正极材料电化学性能的影响,为分析非晶正极材料的储能机理及增强机制提供了新思路。最后,本文对未来非晶正极储能研究方向提出了建议。
1 非晶正极材料的特性
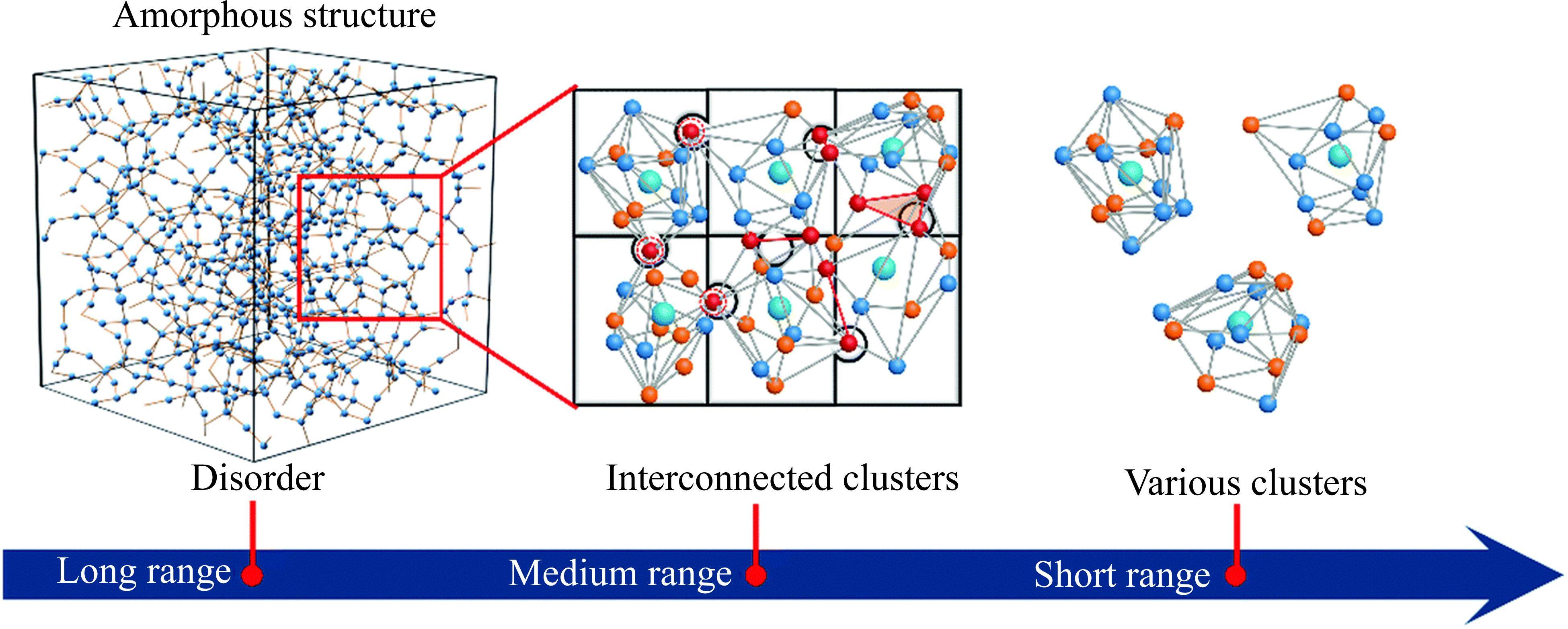
在晶体结构中,原子规则排列形成晶胞,具有明确的晶向和晶面,因此具有高度的稳定性和独特的物理性质[19]。相比之下,非晶材料在原子尺度上缺乏长程周期性,只表现出短程有序、随机链接和高度的各向同性(见图1)[20]。由于非晶正极材料的各向同性原子环境、高度不饱和配位、丰富的表面悬挂键、高电子电导率和原子尺度柔韧性,使许多非晶型正极表现出优异的电化学性能,例如较高的平均工作电位,较好的倍率性能,较高可逆性和稳定的循环性能等。
1.1 较高的平均工作电位
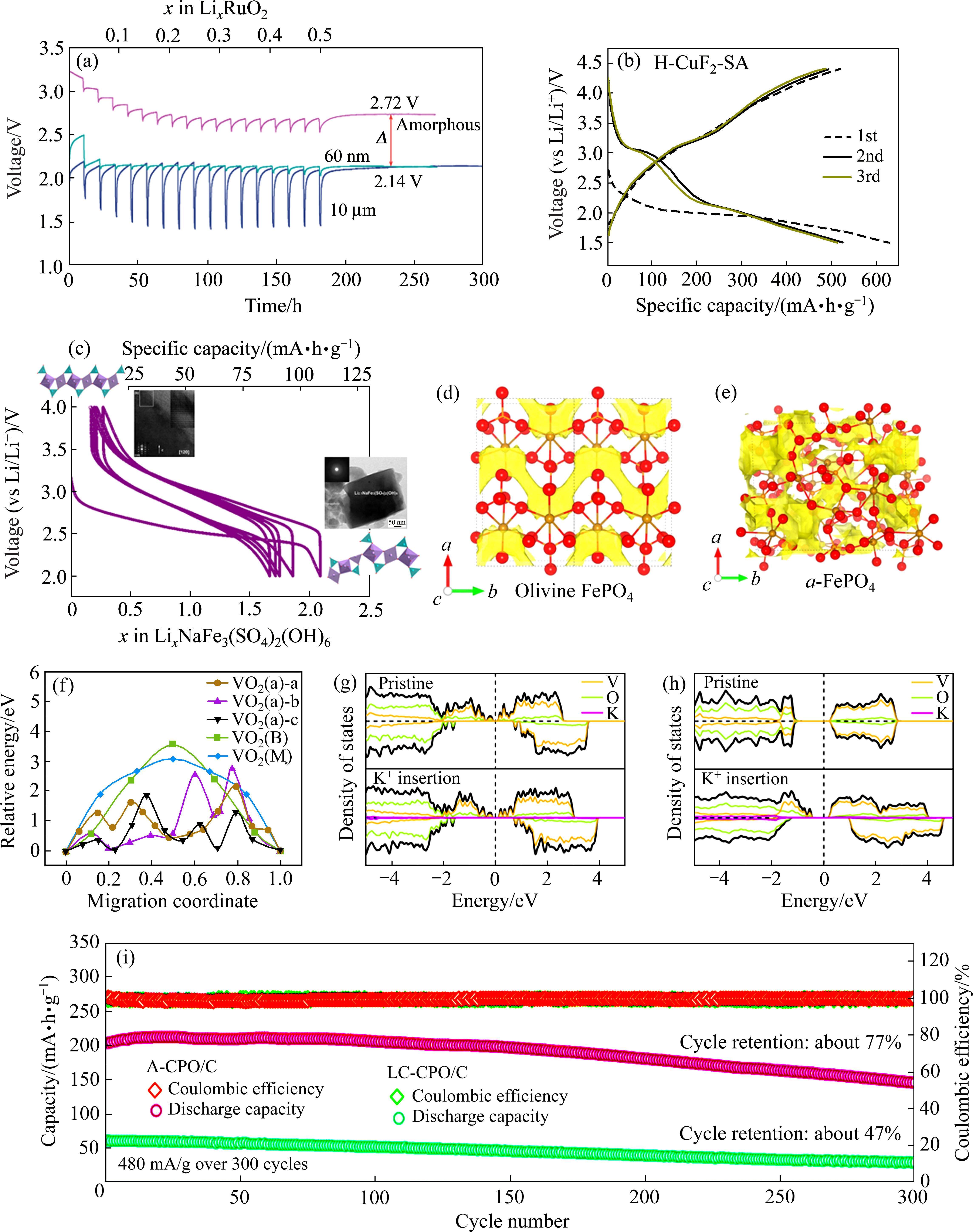
电池的平均工作电压由离子交换反应的自由焓决定,该反应涉及碱金属离子在电极材料中的嵌入和脱出[21]。与晶相正极材料相比,非晶相材料嵌入Li+反应的吉布斯自由能更低,因此,设计非晶正极有望提升电池的平均工作电压。DELMER等[22]对比了60 nm晶相、10 μm晶相和非晶相RuO2三种正极材料电化学嵌锂反应的吉布斯自由能变化,极低倍率恒电流间歇滴定(GITT)模式下非晶相RuO2比晶相RuO2嵌锂的平均电位高约0.58 mV(见图 2(a))。研究表明,非晶相的平均工作电位的增加不仅归因于非晶材料纳米化后表面能的增加,还与非晶的结构和极化变化相关。正极材料的纳米化可以在一定程度上提升电极电位,主要归因于表面能增加、离子扩散路径缩短以及量子尺寸效应等因素[23]。实际上,当碱金属离子首次嵌入转换型正极材料时,巨大的体积变化十分容易形成非晶或纳米晶相。例如CuF2首次嵌入Li+后,第二次放电电压从2.0 V提升至2.4 V(见图2(b))[24]。非晶材料的不饱合活性位点能够降低Li+嵌入非晶材料的能垒,从而降低极化并提高电压。例如,WU等[25]在GITT测试中发现非晶相VO2具有比晶相VO2更小的极化电位,有助于提高电池电压。此外,在有些正极材料,如Fe1.13(PO4)(OH)0.39(H2O)0.61[26]、NaVO3[27]、NaFe3(SO4)2(OH)6[28]中晶相到非晶相转变是可逆的(见图2(c)),这种晶体结构转变同样伴随着工作电压的提高。
1.2 快速离子传导和较低带隙
由于非晶材料无序的原子排列,存在大量局域结构,离子在材料内部迁移时不易受到原子的周期性阻碍,使其比晶体材料的局部应力大大降低,从而具备更快的离子扩散速率,非晶相的形成会降低碱金属离子的迁移能垒并提高电极的本征电子电导率。KIM等[29]通过大经典蒙特卡洛(GCMC)模拟确定了非晶相FePO4中的Na+位点,并使用键价和(BVS)法计算了Na+在晶相和非晶相FePO4中的扩散路径,Na+在非晶FePO4中的路径是随机且无序的,而在橄榄石NaFePO4则沿b方向隧道一维扩散(见图2(d)和(e))。因此,非晶相FePO4结构中相邻Na位点之间的跳跃活化能更低。
钒基氧化物VO2从晶相转为非晶相时,其迁移能垒同样显示出降低的趋势。WU等[25]使用密度泛函理论(DFT)计算出非晶相VO2(a)中三条迁移能垒分别为2.15、2.74和1.85 eV,而晶相VO2(M)中的迁移能垒约为3 eV(见图2(f)),其较大的迁移能垒阻碍了离子的快速传输。此外,非晶材料的局域结构通常具有密集的能级,额外能级的引入可以降低材料的带隙。非晶相VO2(a)具有自旋极化的金属电子结构,其态密度(DOS)中的费米能级附近没有带隙(见图2(g)),且K+的嵌入对其电子结构没有产生明显的影响。相比之下,晶相VO2 (M)显示出清晰的非极化DOS,其带隙为0.99 eV(见图2(h))。因此,非晶相相比晶相通常具有更低的扩散能垒和带隙,能够提高电极的电子电导率和离子扩散速率,从而进一步提升其电化学性能。
1.3 高容量的可逆电化学循环性能
电化学反应的可逆性取决于电极材料的离子电导率和电子电导率,其很大程度上受结构稳定性影响。非晶材料具有各向同性,无晶界等特点,相比于晶相具有原子尺度的柔韧性,可以提供更大的自由体积,从而缓解碱金属离子嵌入和脱出过程中的体积变化,防止结构坍塌。由于磷铁钠矿相NaFePO4不具备足够的离子传输通道,被认为具有较低的电化学活性。然而,XIONG等[30]使用高能球磨法获得了非晶NaFePO4,非晶相转变增大了Na+传输通道并具有更大的自由体积,不仅激活了其电化学活性并表现出良好的循环稳定性。这种通过非晶相转变激活电化学活性的策略为电极设计提供了新思路。此外,LIU等[31]对晶相和非晶相FeVO4正极进行了比表面积测试,非晶相FeVO4的表面积约为41.06 m2/g,而晶相FeVO4的表面积仅为15.64 m2/g。非晶电极增大了电解质与活性材料的接触面积,进一步提高了电池的可逆容量。LEE等[32]制备了晶相和非晶Cu(PO3)2正极,发现非晶相表现出更出色的循环性能(见图2(i)),在480 mA/g的电流密度下循环300次后,容量保持率为77%,库仑效率高达99%。
2 非晶正极材料的合成策略
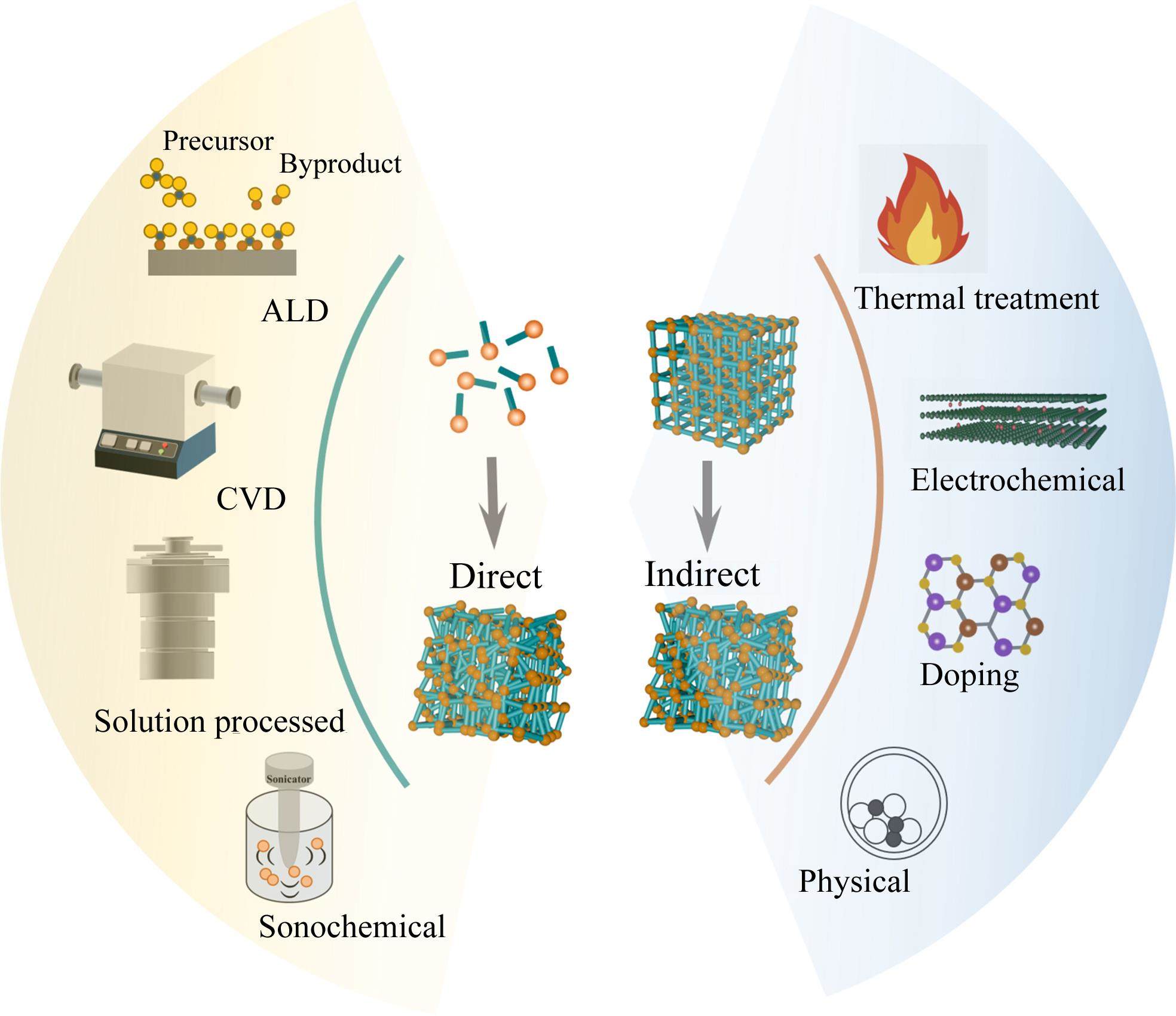
近年来,已开发的非晶材料直接制备工艺主要包括熔体淬火法、机械合金化、水热法、原子层沉积技术(ALD)、物理气相沉积(PVD)、电化学沉积法、激光熔覆技术等(见图3[33])。但这些直接合成非晶材料的工艺主要用于合成合金、催化剂和半导体材料,在正极材料的制备中尚未获得广泛应用。对晶体正极材料进行非晶化转变策略,操作简单且经济有效,是目前报道较多的非晶正极材料的主要制备方法[34]。这里我们主要针对机械球磨法和电化学非晶化两种常用策略进行简要介绍。
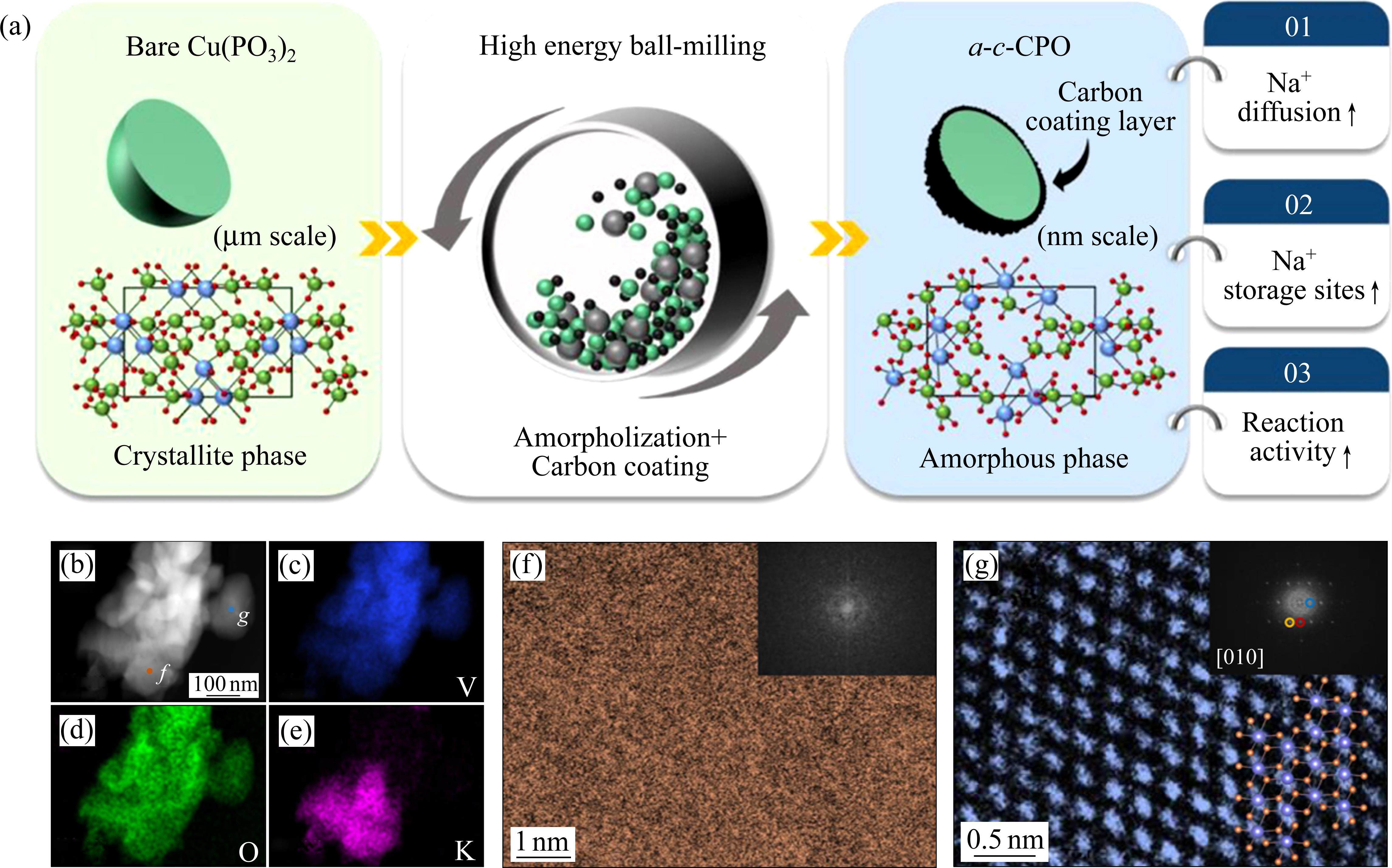
球磨法是一种基于高速旋转和冲击的机械力轰击晶体,使晶体内部产生剧烈的应力和变形,产生局部高温和高压,通过引入大量的晶格缺陷和位错,晶粒的细化和晶界滑移以实现晶格转变的方法,具有高效、节能和能大批量生产的优点(见图4(a))。LEE等[35]将晶体Cu(PO3)2正极以500 r/min的转速行星球磨24 h后,得到非晶相Cu(PO3)2。与有序结构的晶体材料不同,非晶相具有更多的离子扩散通道和更短的扩散路径。KAPAEV等[36]证明,与低电化学活性的磷铁钠矿NaFePO4相比,球磨法得到的非晶相NaFePO4正极表现出更高的电化学活性。
电化学非晶法是通过将材料在特定的电化学条件下(原位电化学、电沉积等),在电化学反应的驱动下引入应力和缺陷,促使原子排列失去长程有序性,从而使其结构由晶相转为非晶相的策略[37]。其中,原位电化学非晶化策略制备非晶正极具有独特的优势,由于重建的非晶正极可以在电化学循环中反复使用。具体而言,随着碱金属离子(如Li+、Na+和K+)在正极材料中的嵌入与脱出(特别是转换型正极),巨大的体积变化导致晶体电极的晶格断裂形成非晶相。WU等[25]将K+嵌入晶相VO2中,扫描透射电子显微镜(STEM)中的高角度环形暗场(HAADF)图像显示,V和O元素均匀分布在选定区域(见图4(c)和(d)),而K元素仅存在于某些特定区域(见图4(e))。高分辨率透射电子显微镜(HRTEM)图(见图4(b)中的f处)显示特定区域为无序结构(见图4(f)),而没有K元素的区域(图4(b)中的g处)则显示出有序结构(见图4(g))。这表明,随着K+的嵌入,巨大的体积变化导致晶相VO2转变为非晶相VO2。SHEN等[38]利用ZnV2O4的原位电化学非晶化得到非晶相电极,其在20 A/g的高电流密度下循环3000圈后,仍保留了217.2 mA∙h/g的比容量,容量保持率为73.63%。
3 非晶电极的表征方法
由于非晶材料具有长程无序性,结构复杂性,以及对高能电子和高分辨率的要求,使用传统晶体表征的衍射、光谱和成像技术对其结构进行分析所获取的信息十分有限。例如,尽管X射线衍射(XRD)能确定材料是否呈无定形状态,傅里叶变换红外光谱(FTIR)、拉曼光谱(Raman)可以提供化学键合和分子结构信息,它们却无法提供非晶材料详细的局部结构信息;扫描电子显微镜(SEM)、比表面积分析(BET)、X射线光电子能谱(XPS)可用于分析非晶材料的表面形貌、孔隙结构、化学成分和元素价态,但无法提供体相结构信息;高分辨率透射电子显微镜(HRTEM)和扫描透射电子显微镜(STEM)可以观察到纳米级别的微观结构和局部有序性,但非晶材料容易受到辐照损伤,导致结构的改变或损坏,从而影响表征结果的准确性。
为了从原子尺度更精确地捕捉非晶电极材料的结构信息,近年来出现了更多包含同步辐射在内的先进表征手段,如核磁共振(NMR)、X射线吸收谱(XAS)和小角X射线散射(SAXS)等技术[39]。此外,可以结合多种理论计算,如从头算分子动力学(AIMD)模拟、密度泛函理论(DFT)计算、蒙特卡洛方法(Monte Carlo)等,与以上实验表征分析结合,更深入地描述非晶正极材料的结构及性质(见图5[40])。以下将对几种常用的实验和模拟计算在非晶电极材料表征中的应用做简单介绍。
3.1 实验表征
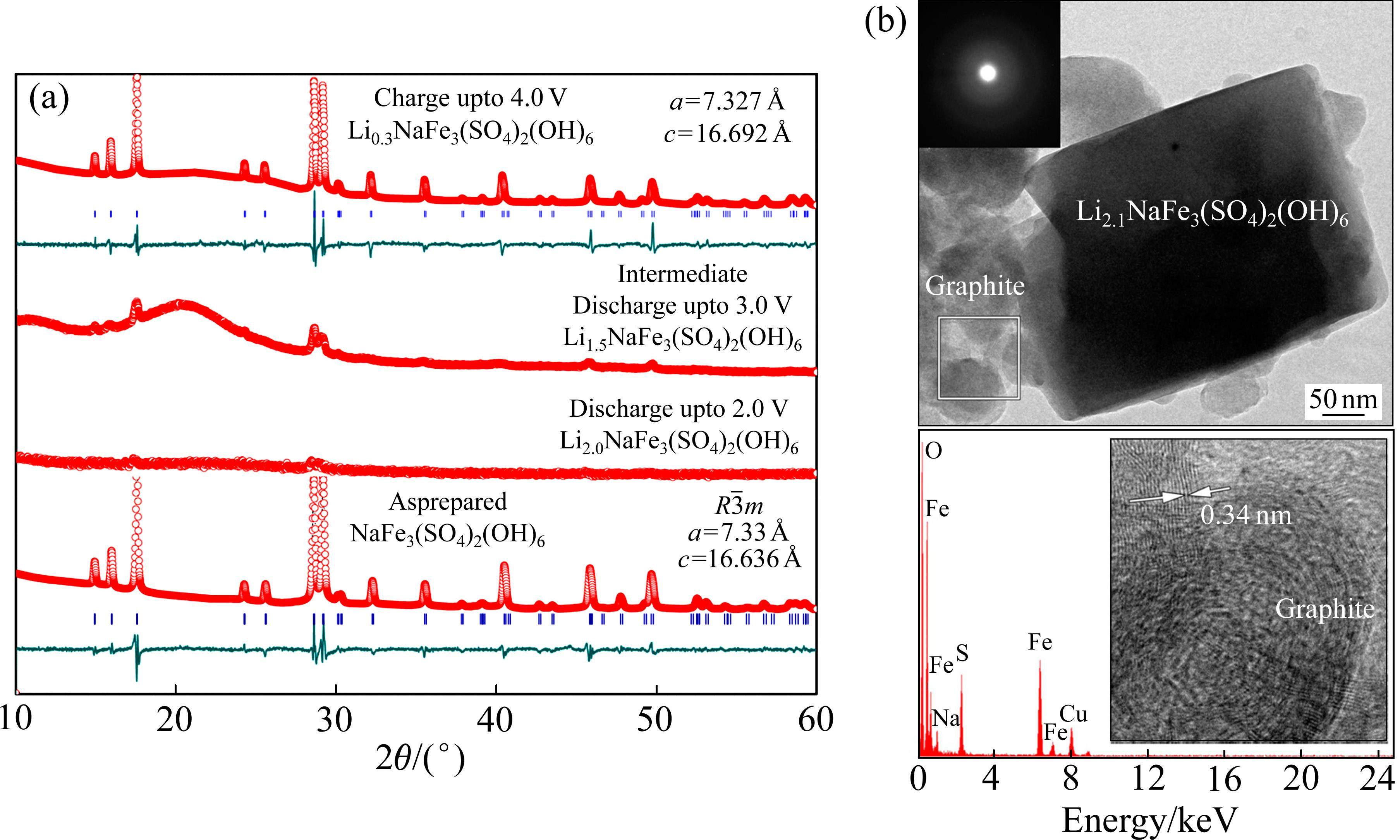
GNANAVEL等[28]使用XRD和TEM测试发现NaFe3(SO4)2(OH)6正极在锂化后,其结构由晶相转为非晶相(见图6[28]),但这两种测试均无法阐明详细的微观结构变化。用于描述非晶结构中原子之间距离分布最常用的分析方法是对分布函数(PDF),其可以通过对材料的XRD、中子或电子的总散射数据进行傅里叶变换得到。它表示在一个原子附近,另一个原子相距r的概率密度,被广泛应用于非晶材料和纳米尺度材料的研究[40]。XIANG等[41]对Na0.3FePO4和Na0.6FePO4的PDF进行精修,发现了一种应变调节机制(见图7(a)),即通过形成无定形中间相来缓解橄榄石晶型NaFePO4的晶格失配,从而降低电极相变过程中的体积应变,有助于提高电池的循环稳定性。LI等[42]通过对非晶相和晶相FeF3的电子衍射图进行转换得到相应的PDF(见图7(b)),结果表明晶相FeF3在大于6 Å的范围内表现出更明显的峰,而非晶相仅在短程区域存在明显的峰。非晶相中更松弛的FeF6八面体排列为Li+的快速传输提供了基础。
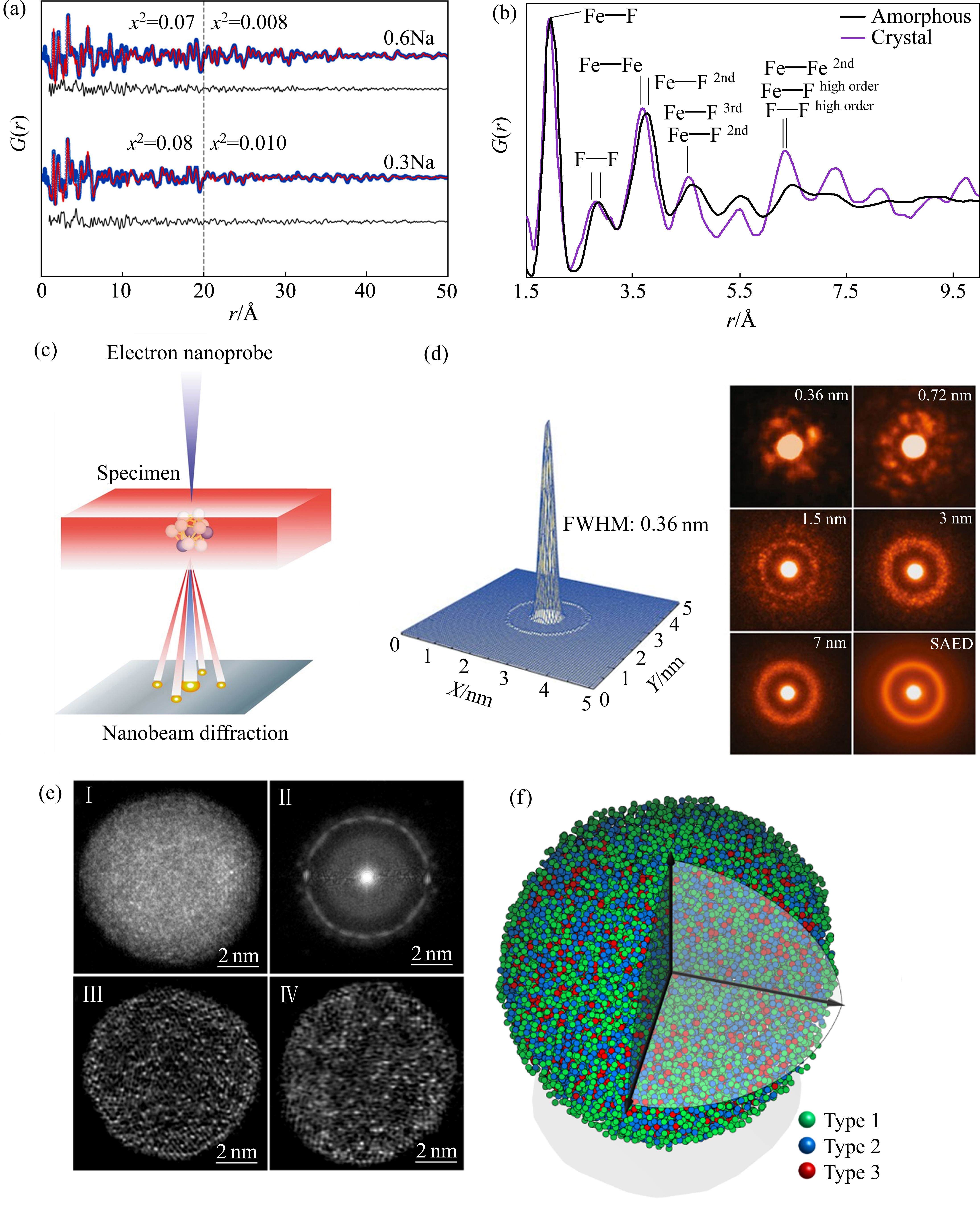
尽管通过TEM可以确认材料的非晶特征,但其2D投影特点限制了进一步的定量分析。随着球差校正技术的发展,TEM的分辨率可以达到亚埃级[43]。图7(c)显示了球差校正TEM从样品中的原子团簇采集纳米束电子衍射(NBED)的示意图。NBED利用直径小于1 nm的相干电子束,从纳米级区域获取二维衍射图以检测局部原子结构。当半峰宽直径减小到约0.36 nm时,观测到一组两重对称光斑的衍射图(见图7(d))[44]。原子电子断层扫描(AET)集成了HAADF-STEM的原子级分辨率、高分辨率断层扫描倾斜系列和迭代算法,其具有直接确定非晶态固体三维原子结构的能力,能够在原子尺度上定量分析短程和中程有序结构[45]。YANG等[46]使用AET确定了非晶材料的三维原子位置(见图7(e)和(f)),证实了一些短程有序单元相互连接形成晶体状超星系团并产生了中程有序结构。
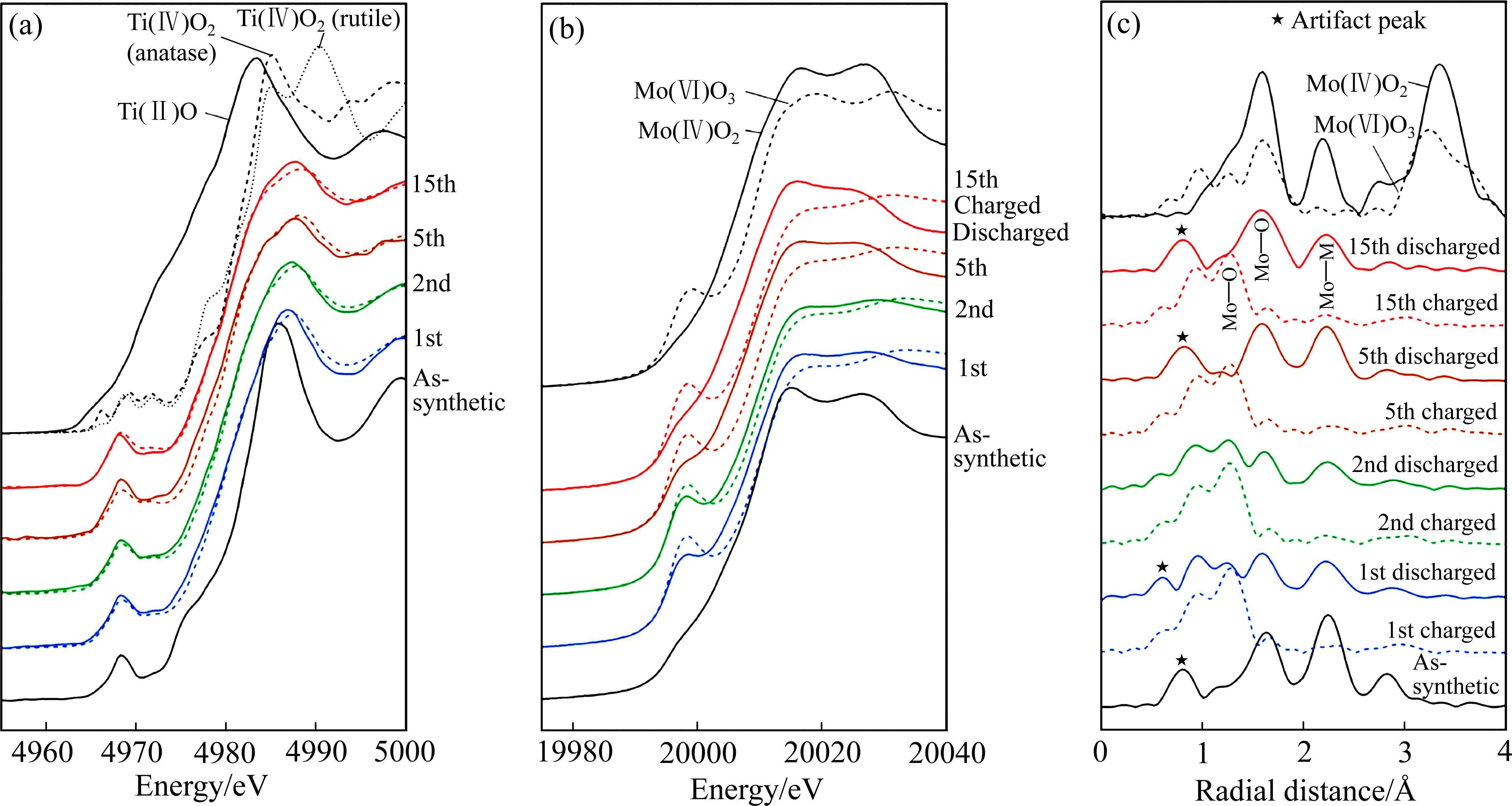
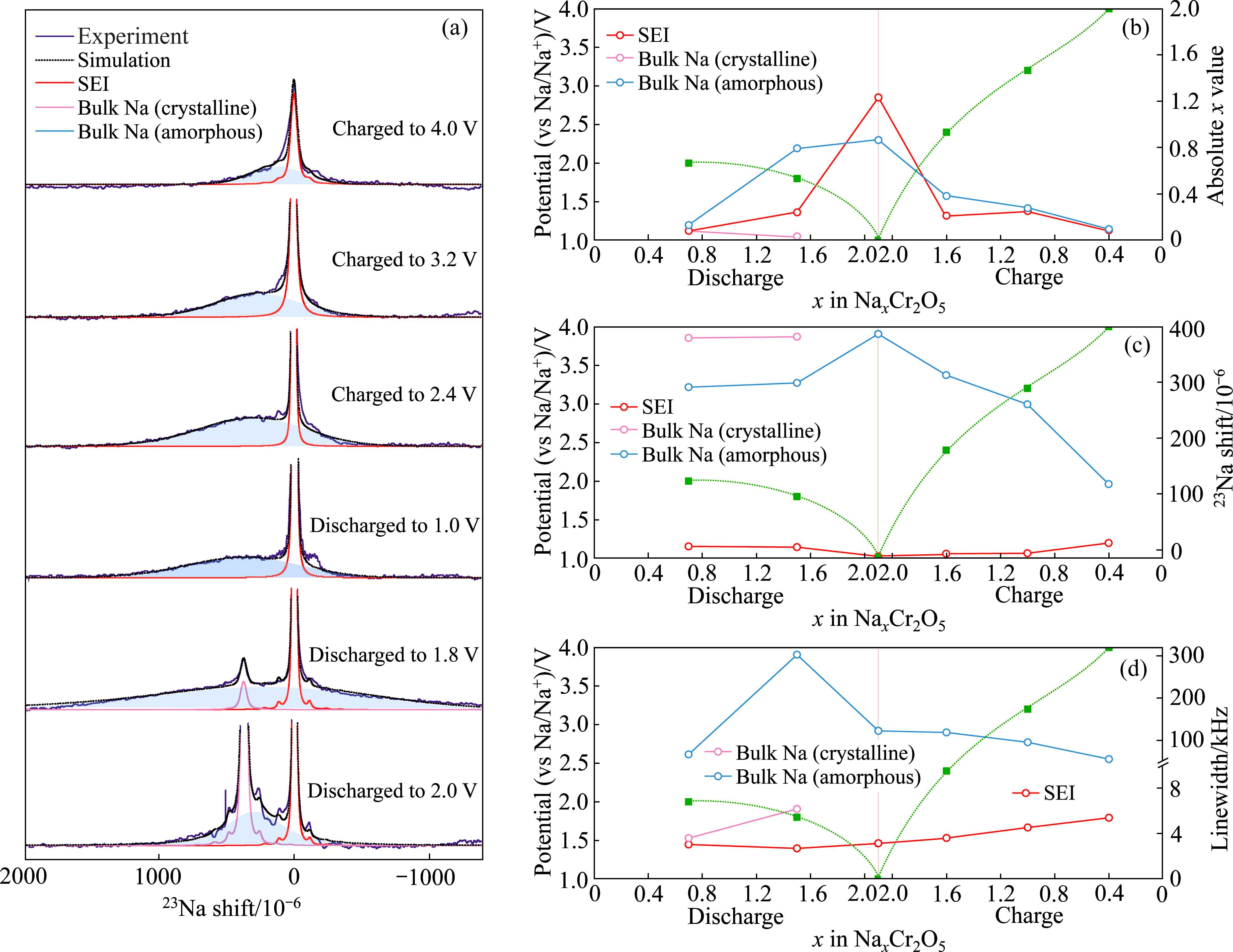
X射线吸收谱(XAS),包括X射线吸收近边结构(XANES)和扩展边X射线吸收精细结构(EXAFS),通常用于分析目标原子周围的电子结构和配位环境[47]。KAWAGUCHI等[48]使用非原位XANES光谱阐明了Li2Ti1/3Mo2/3O3中过渡金属Ti和Mo的价态变化(见图8(a)和(b)),并且采用EXAFS证明了Li2Ti1/3Mo2/3O3正极在电化学非晶化后,短程有序的MoO6八面体团簇仍然存在(见图8(c))。核磁共振(NMR)对化学键的类型和键长十分敏感,能提供丰富的有关非晶材料局部结构环境、离子动力学和化学信息[49]。FENG等[50]使用高分辨率固态23Na NMR光谱定性和定量地揭示了Na+第一次嵌入晶体Cr2O5电极后形成非晶相(见图9[50]),并在后续循环中可逆的脱嵌,并阐明了Na+主要在低电位下参与固电解质界面的形成。
3.2 模拟计算
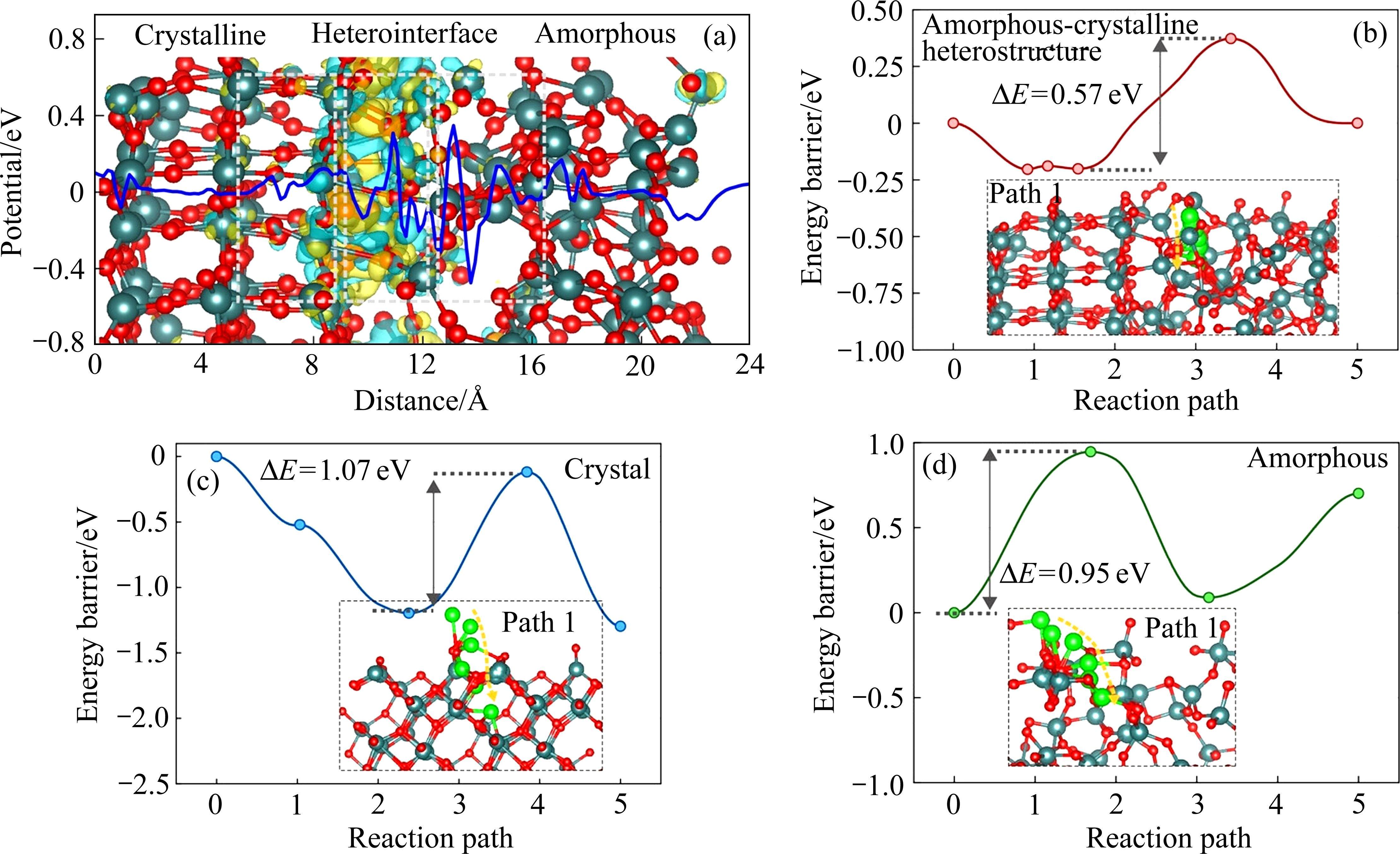
将NMR、XAS、X射线和中子散射的实验结果与模拟计算(包括分子动力学(MD)模拟、DFT计算和蒙特卡洛方法等)结合,可以更好地预测和描述非晶材料的结构特征、动力学性能及储能机理[51]。WANG等[52]对非晶-结晶异质结构VOx进行了AIMD模拟和DFT计算,发现非晶-结晶界面处的电荷分布表现出明显的电子转移(见图10(a))。由于局部电荷转移,产生内置电场和空间电荷域,从而加速了电极的电荷载流子迁移率。与晶体结构(1.072 eV)和非晶结构(0.946 eV)相比(见图10(b)~(d)),非晶-结晶异质结构表现出最低的扩散能垒(0.573 eV)。此外,非晶-结晶异质结构表现出更大的吸附能,在非晶相的ZnV2O4中也得到了类似的结果。SHEN等[38]发现,锌原子在ZnV2O4上的吸附能从晶相的-0.219 eV增加到非晶相的-0.312 eV,原位电化学非晶化电极捕获Zn2+的能量势垒显著降低(见图11(a))。此外,差分电荷密度证实了非晶结构与锌原子的结合能增加(见图11(b))。
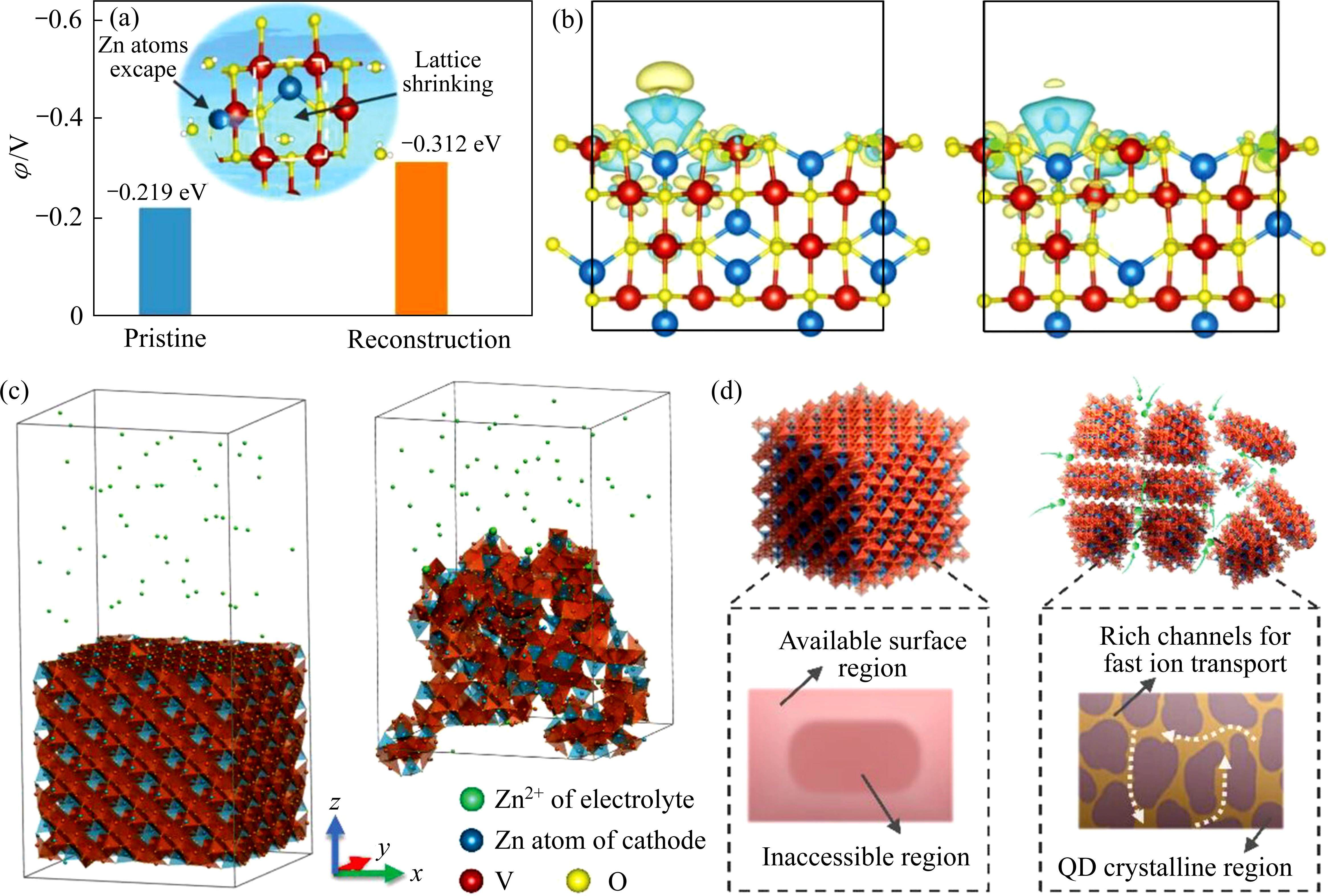
MD模拟广泛用于研究非晶纳米材料的形成过程、热稳定性、力学性能、动态行为和缺陷特性。SHEN等[38]通过MD模拟比较了电化学非晶化前后两个体系中Zn2+扩散的难易程度。其中,非晶结构在运行20 ns后有7个Zn原子扩散到体相,而Zn2+很难进入晶体结构(见图11(c)和(d))。原位电化学非晶化破坏了晶体的长程有序结构,电极的可用存储位点和离子扩散路径增加,从而实现了卓越的电化学性能。
4 碱金属离子电池中的非晶正极
碱金属离子电池(LIBs、SIBs和KIBs)作为高效储能器件,在从小型电子设备到大型电网储能系统的各应用领域中发挥着至关重要的作用[53-55]。正极材料是决定电池电化学性能的关键组成部分,因此,许多材料(包括转换型和非转换型电极)已被设计、开发和评估用于碱金属离子电池的正极[56]。研究发现,具有大量缺陷和空位的非晶正极材料显示出高比容量和循环稳定性,甚至超过相应的晶体材料。UCHAKER等[57]证明,非晶相V2O5正极在SIBs中表现出优于相应晶体的循环稳定性,因为各向同性的非晶材料具有更快的法拉第反应。
4.1 非转换型正极
Li2VO2F作为锂离子电池的正极材料,理论比容量高达462 mA∙h/g。HIROI等[58]对不同充放电状态下的LixVO2F进行了X射线全散射测量,经转换的PDF表明其晶体结构在脱锂时部分转变为非晶相,并贡献了277 mA∙h/g的高比容量。钒基氧化物电极材料的多氧化态赋予了其高比容量,同时这类材料具有丰富的晶体结构、低成本和高稳定性等优点,因此备受关注[59]。研究人员证明,非晶相V2O5和V2O5-P2O5固溶体可用作LIBs的正极材料[60]。KONG等[61]通过熔体淬火法制备了一系列V2O5-Li3PO4-CaC2正极材料,并评估了其在LIBs中的电化学性能。其中,非晶相75V2O5-25Li3PO4-20CaC2在100 mA/g的电流密度下循环100次后,容量保持率为87.8%。为进一步提高钒和磷氧化物的循环稳定性,DU等[62]利用还原气氛熔融V2O5-P2O5以改变其结构和钒离子不同价态的比例,其在0.1C下循环100次后,显示出243 mA∙h/g的超高容量和90%的容量保持率[62]。
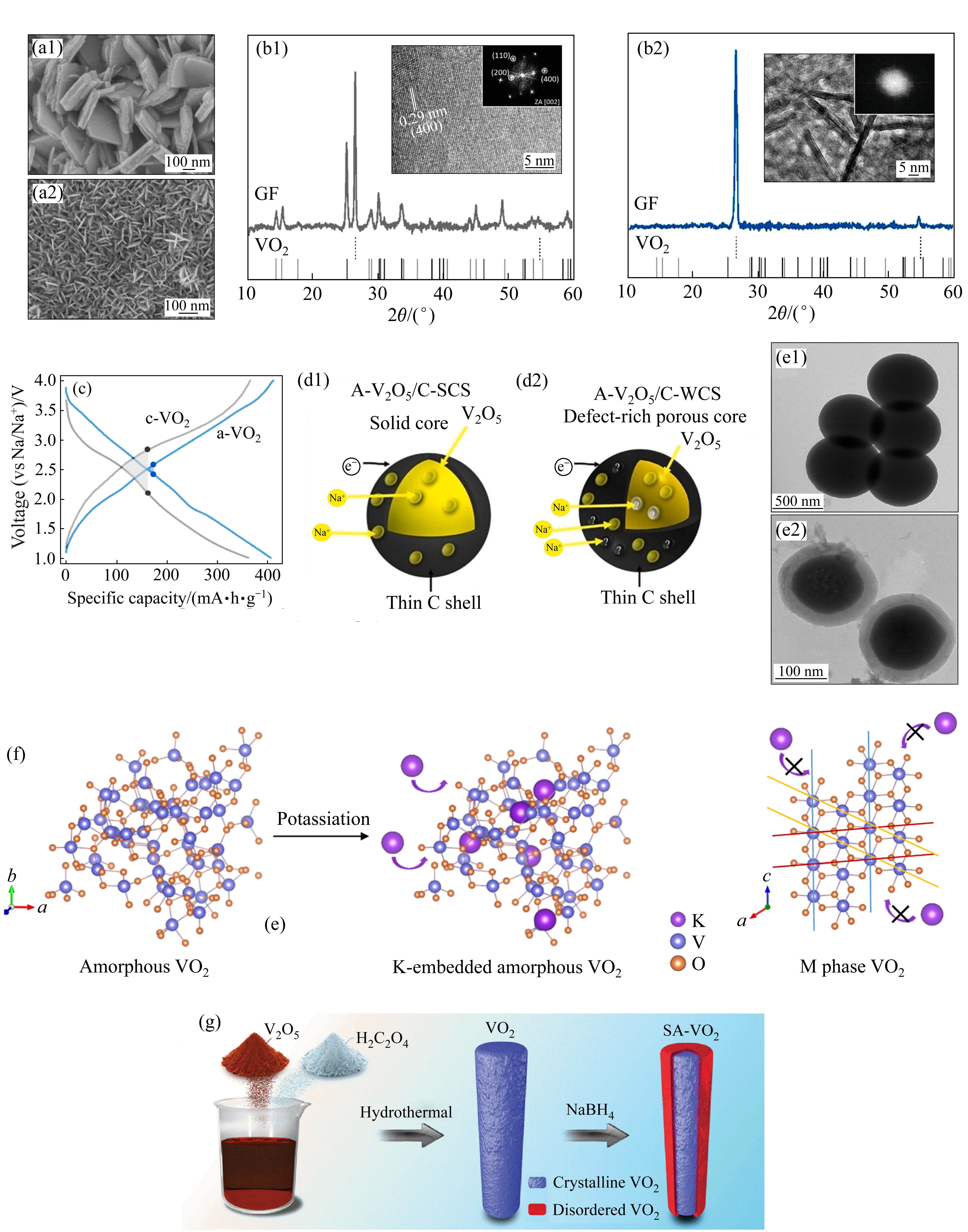
CHAO等[63]使用水热法在石墨泡沫(GF)支架上分别制备了晶相VO2和非晶相VO2纳米片,以XRD和TEM验证了其结构(见图12(a1)、(a2)和(b1)、(b2))。晶相和非晶相VO2均显示出倾斜的充放电曲线,相较于晶相VO2较大的极化电位(680 mV),非晶相VO2的极化电位仅有90 mV(见图12(c)),表明非晶相VO2具有快速的Na+储存性能。合理设计微观结构或碳涂层有助于进一步提高非晶正极材料的电化学性能[64]。OSMAN等[65]制备了不同结构的碳包覆V2O5正极材料,其中非晶相V2O5实心核壳异质结构(A-V2O5/C-SCS)和非晶相V2O5多孔核壳异质结构(A-V2O5/C-WCS)的示意图和TEM分别如图12(d1)、(d2)和(e1)、(e2)所示。由于多孔核壳异质结构具有高度的各向同性,Na+可以在其中快速扩散,因此表现出最低的迁移能垒(0.25 eV)。同时,A-V2O5/C-WCS显示出优异的循环稳定性,在1.0 A/g的电流密度下循环1000次后依然具有191 mA∙h/g的高比容量,容量保持率超过98%。FANG等[66]制备的非晶微型花状结构NaVOPO4正极材料,具有快速的离子迁移速率和高结构稳定性。NaVOPO4电极表现出高电压(约3.5 V vs Na/Na+)、高可逆容量(0.05C时为110 mA∙h/g)和出色的循环稳定性(2000次循环后,容量保持率为96%)。
钒基氧化物同样可以用作KIBs的电极材料,WU等[25]使用AIMD模拟构建了非晶相VO2,图12(f)为K+嵌入非晶相和晶相VO2的示意图。由于K+较大的离子半径(约1.38 Å),其难以有效进入晶体晶格,然而由于非晶结构扩充了离子迁移通道,K+能够可逆地脱嵌于非晶VO2中,因此非晶化提高了VO2电极在KIBs中的电化学性能。LI等[67]通过对VO2纳米棒表面非晶化,形成结晶核-非晶壳异质结构的VO2(SA-VO2)(见图12(g)),在KIBs中表现出高比容量(电流密度50 mA/g时比容量为288.3 mA∙h/g)、优异的倍率性能(电流密度2000 mA/g时比容量为141.4 mA∙h/g)和长循环稳定性(500 mA/g电流密度下循环500圈后,容量保持率为86%)。此外,Mo3VOx等[68]和FeVO4等[69]也被证明可用作非晶正极材料。
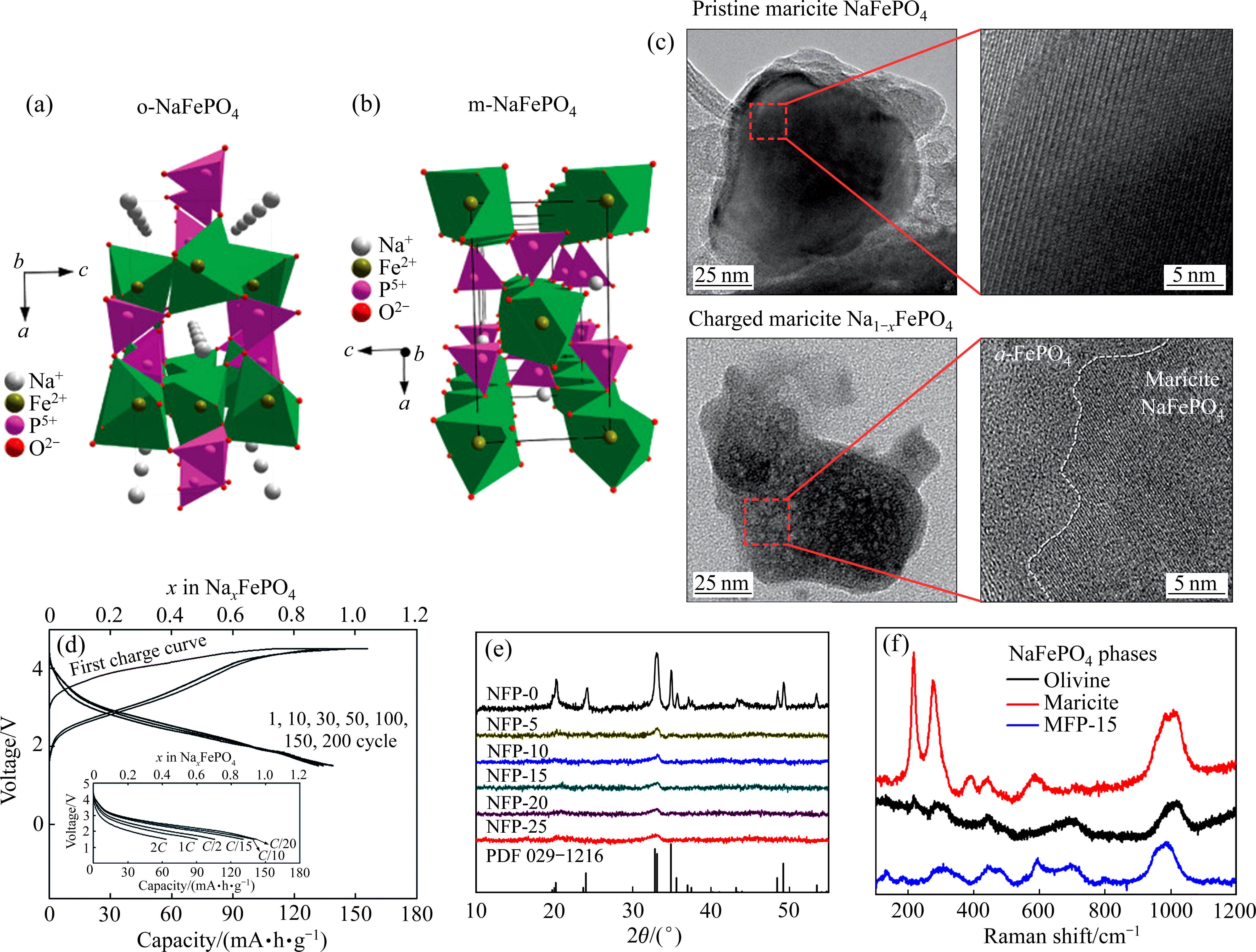
由于LiFePO4在锂离子电池中成功的商业应用,人们自然地将目光转向钠离子电池正极材料应用中的NaFePO4材料。NaFePO4具有橄榄石相(o-NaFePO4)和磷铁钠矿(m-NaFePO4)两种结构。其中,o-NaFePO4具有较大的Na+传输通道(见图13(a)),却热力学不稳定无法直接合成。m-NaFePO4热力学稳定,但Na+在该晶相中的传输通道被阻塞(见图13(b)),仅有较低的电化学活性,限制了其进一步应用[70]。研究发现,通过电化学或机械法将晶相m-NaFePO4转化为非晶相,可显著增强其储钠性能。KIM等[29]通过在4.5 V电压保持充电5 h,激活了m-NaFePO4的电化学活性(见图13(d))。TEM观测到m-NaFePO4在高电位脱钠过程中转化为非晶相FePO4(见图13(c))。非晶相NaFePO4实现了142 mA∙h/g的高可逆比容量,且在200次循环后容量几乎未衰减。XU等[71]在Na4Fe3(PO4)2P2O7中添加一定量的NaFePO4,其中NaFePO4纳米晶连续分布在Na4Fe3(PO4)2P2O7晶域相中并被其包裹,大量的过渡晶界区域有利于钠离子交叉传输,从而有效地激活了惰性NaFePO4的电化学活性。NaFePO4在首圈充电过程中发生了非晶化转变,之后在非晶态下循环。最终,Na4.5Fe3.5(PO4)2.5P2O7实现了高达130 mA∙h/g的可逆容量和400 W∙h/kg的能量密度。
除了使用电化学法实现对m-NaFePO4非晶化,麦立强等还使用高能球磨得到非晶相m-NaFePO4。随着高能球磨时间的延长,晶相m-NaFePO4的XRD衍射峰和晶格逐渐消失,最终形成非晶相NaFePO4(见图13(e))。阐明非晶化过程中原子尺度结构变化对电化学性能的影响至关重要。球磨所得非晶相NaFePO4的拉曼光谱显示,位于200~400 cm-1区域的位移峰在非晶样品中消失,表明共边FeO6八面体断裂(见图13(f))。O K-edge X射线吸收近边光谱的结果验证了非晶化后氧配位数的减少,可能产生了一些低配位的FeOx多面体结构,这种结构变化有利于Na+的快速传输[30]。完全非晶化的NaFePO4表现出最优的电化学性能,在1C倍率下初始容量为115 mA∙h/g,800次循环后容量保持率为91.3%。此外,FePO4正极材料也被应用于碱金属电池中,由于晶相FePO4内部通道较窄导致在SIBs和KIBs中的可逆容量较低,而短程有序的非晶相FePO4在充放电过程中可为Li+、Na+和K+提供足够的连续通道,具有更高的电化学活性[72]。
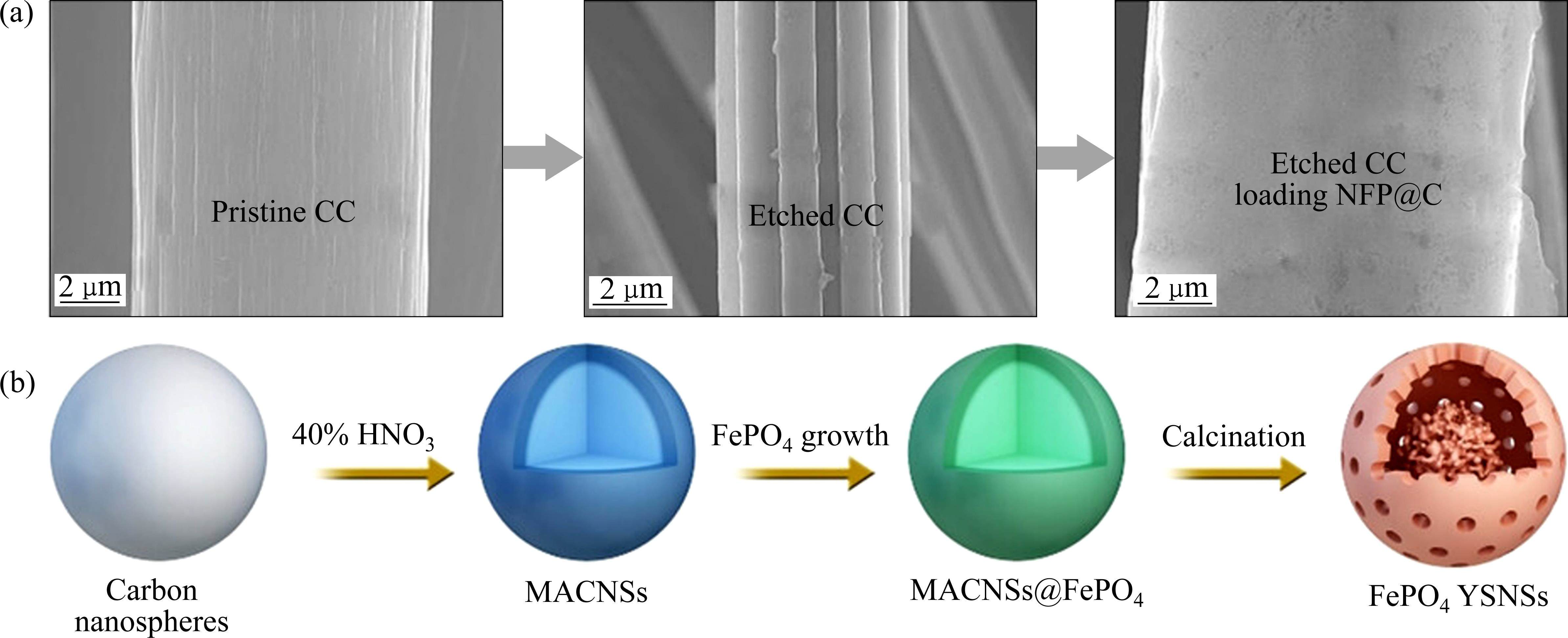
然而,非晶相NaFePO4或FePO4仍然存在电子电导率低和扩散动力学差等问题。为此,研究人员探索了多种方法来改善非晶相NaFePO4或FePO4的电化学性能,如纳米工程、形貌调控以及碳包覆等策略[73]。MA等[74]将m-NaFePO4生长在刻蚀后的高比表面积碳布上(见图14(a)),这种复合材料具有更高的可逆比容量和出色的循环稳定性。另外,ZHANG等[75]制备了一种蛋黄壳结构的非晶相FePO4纳米球(见图14(b))。由于其独特的结构优势,非晶相FePO4蛋黄壳纳米球显示出增强的电化学性能,具有较大的可逆容量(10 mA/g电流密度下具有153.9 mA∙h/g的比容量)和优异的循环稳定性(100 mA/g电流密度下循环1000次后,容量保持率为91.3%)。
4.2 转换型正极
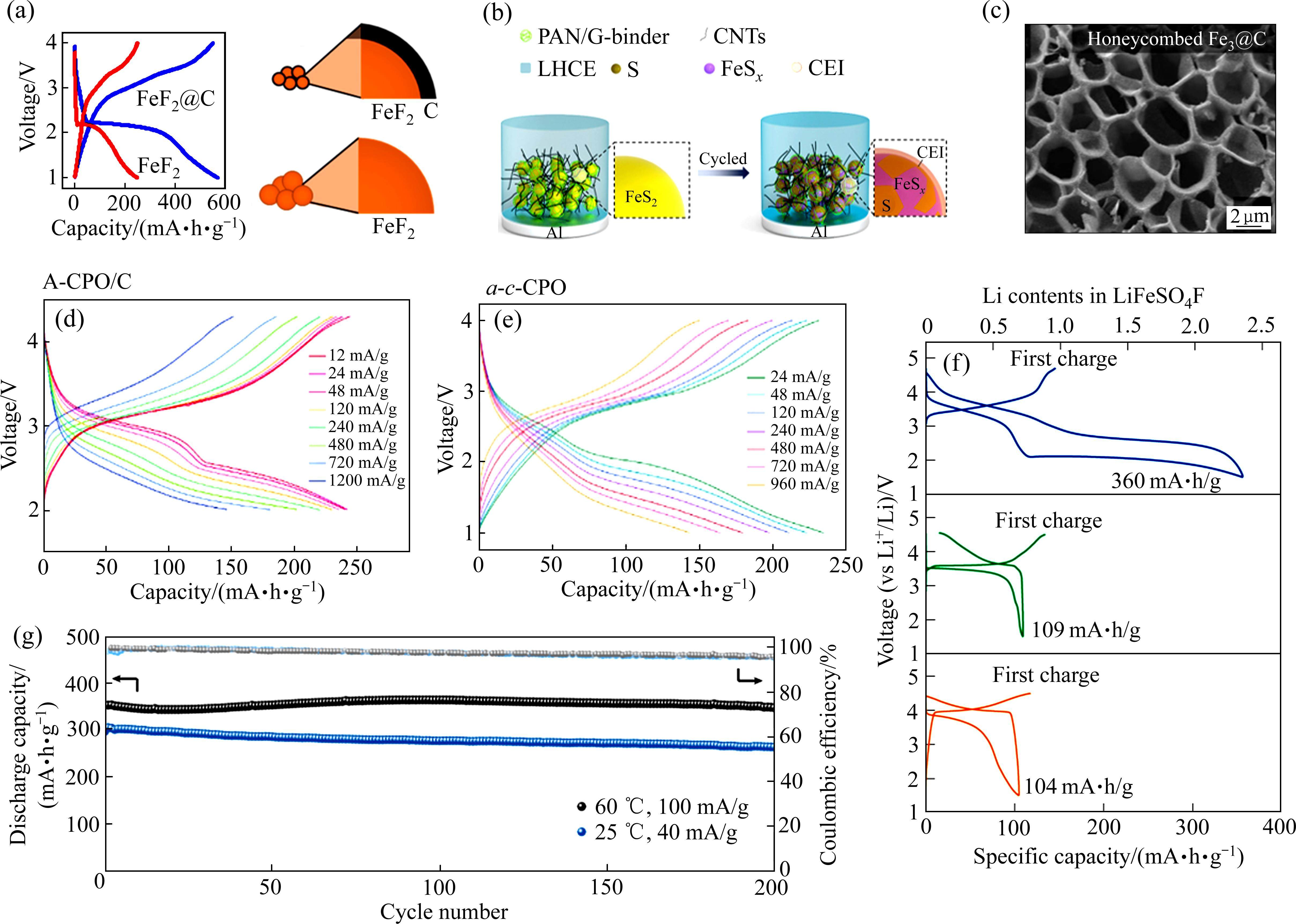
转换型正极材料可以与碱金属离子发生多电子的可逆氧化还原反应,改变至少一种金属的氧化态并生成新的化合物。转换型正极主要包括过渡金属氧化物、过渡金属磷化物、过渡金属硫化物和过渡金属硒化物[76]。转换型正极具有超高的理论比容量,是下一代可充电金属电池和金属离子电池的一类关键电极材料。其中,金属氟化物正极能提供较高的理论电压和高能量密度(如CuF2:3.55 V (vs Li/Li+),1009.1 W∙h/kg),在储能系统中展现出巨大的应用潜力。然而,碱金属离子在晶体氟化物脱嵌过程中会发生断键和成键化学反应,并产生相应纳米晶或非晶相产物,与此同时电极产生巨大的体积变化,导致其膨胀分解和脱落,进而造成电池循环稳定性的下降。设计氟化物电极结构,结合碳包覆工艺可以稳定其结构、缓解相变应力和提高电子电导率,从而有效改善金属氟化物正极的电化学性能[77]。WYGANT等[78]制备了直径约35 nm的碳包覆FeF2@C电极,其表面被2~3 nm的碳层包裹,循环后的复合材料表面形成了富含无机组分的正极电解质界面膜(CEI),碳包覆FeF2@C电极显示出优于商用FeF2的电化学性能(见图15(a)),但在循环过程中观察到FeF2向FeF3的不良转变。MAULANA等[79]制备的氮掺杂碳包覆FeF2电极在循环过程中没有发生由FeF2向Na3FeF6和FeF3的不良相变,从而表现出优异的电化学性能(300 mA/g电流密度下循环500次后,容量保持率为79%)。在活性材料表面构建三维导电网络有利于提高电池性能。LI等[80]制备的三维导电网络使FeS2可以缓解Li+脱嵌过程中的体积收缩和膨胀,同时维持了界面稳定性(见图15(b)),在0.5C的倍率下循环700次后,容量保持率为72.6%。
通过设计碳基纳米结构可以有效提高电极的电子电导率。WANG等[81]设计了蜂窝状FeF3@C电极(见图15(c)),其六边形结构加快了Li+和电子的快速传输,在LIBs中表现出卓越的循环稳定性(0.2C倍率下循环1000次后,容量保持率为100%)。WU等[82]制备了具有金属有机骨架(MOF)结构的CoF2@C电极,超小的CoF2纳米颗粒(5~20 nm)均匀地被石墨包覆,并嵌入多孔碳骨架中,使CoF2@C电极实现了高度可逆的转换反应。LI等[42]直接制备了非晶相FeF3正极,其内部缺陷和无序结构拥有更多的Li+嵌入位点和传输路径。
据报道,Cu3(PO4)2[83]和Cu2P2O7[84]可以分别作为转换型正极应用于LIBs和SIBs中。这两种正极材料在第一次放电时均转变为非晶相,并且由于聚阴离子的诱导效应,其工作电压高于转换型金属氧化物正极。LEE等[32]进一步通过高能球磨合成了非晶相Cu(PO3)2,并探究了其在LIBs和SIBs中的电化学性能。该Cu(PO3)2/C电极在12 mA/g的电流密度下产生了240 mA∙h/g的高可逆容量,而且具有约2.8 V的平均工作电压(vs Li+/Li)(见图15(d))。应用于SIBs时,在24 mA/g的电流密度下,其比容量高达232 mA∙h/g,平均工作电压约为2.3 V(vs. Na+/Na)(见图15(e))[35]。
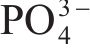
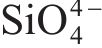
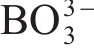
| Sample | Application | Amorphization method | Capacity retention | Ref. |
|---|---|---|---|---|
| 75MoO3-25P2O5 | LIBs | Melt quenching | 43% (291 mA∙h/g at 10 mA/g, 10 cycles) | [91] |
| 80V2O5-20P2O5 | LIBs | Melt quenching | 79.2% (223 mA∙h/g at 0.5C, 300 cycles) | [62] |
| 75V2O5-25Li3PO4-20CaC2 | LIBs | Melt quenching | 87.8% (319 mA∙h/g at 100 mA/g, 100 cycles) | [61] |
| Amorphous 1.3LiF-FeSO4 | LIBs | Ball milling | 100% (131 mA∙h/g at 0.2 mA/cm2, 30 cycles) | [87] |
| Micro-sized FeS2 | LIBs | Electrochemical | 72.6% (620 mA∙h/g at 0.5C, 700 cycles) | [80] |
| FeF3@C nanocomposite | LIBs | Electrochemical | 84.7% (460 mA∙h/g at 0.5C, 1000 cycles) | [81] |
| FeF2@C | LIBs | Electrochemical | 100% (625 mA∙h/g at 0.05C, 50 cycles) | [78] |
| CoF2 | LIBs | Electrochemical | 96% (500 mA∙h/g at 0.2C, 200 cycles) | [82] |
| CuF2 nanoparticles | LIBs | Electrochemical | 77.8% (420 mA∙h/g at 26.4 mA/g, 50 cycles) | [24] |
| Amorphous LiFeSO4F | LIBs | Ball milling | 90% (300 mA∙h/g at 40 mA/g, 200 cycles) | [85] |
| Cu3(PO4)2 | LIBs | Electrochemical | 61.1% (425 mA∙h/g at 10 mA/g, 400 cycles) | [83] |
| Amorphous Cu(PO3)2/C | LIBs | Ball milling | 77% (200 mA∙h/g at 480 mA/g, 300 cycles) | [32] |
| Amorphous CuFe2F6O | LIBs | Microwave-assisted solvothermal | About 63% (230 mA∙h/g at 10 mA/g, 10 cycles) | [89] |
| Amorphous VO2 | SIBs | Solvothermal reaction | About 95% (130 mA∙h/g at 20C, 500 cycles) | [63] |
| Amorphous V2O5 | SIBs | Electrodeposition | 74.1% (241 mA∙h/g at 23.6 mA/g, 100 cycles) | [57] |
| Amorphous V2O5 core-shell | SIBs | Calcination method | 95% (178 mA∙h/g at 2000 mA/g, 3000 cycles) | [59] |
| Mo3VOx | SIBs | Electrochemical | 93% (287 mA∙h/g at 100 mA/g, 30 cycles) | [68] |
| Cr2O5 | SIBs | Electrochemical | 45.5% (310 mA∙h/g at 20 mA/g, 50 cycles) | [50] |
| Amorphous MnO2@PANI | SIBs | Interface reaction | 98.8% (175.4 mA∙h/g at 0.1C, 200 cycles) | [92] |
| Amorphous MnO2 | SIBs | Redox reaction | 95% (139.2 mA∙h/g at 0.1C, 100 cycles) | [93] |
| FePO4 yolk–shell | SIBs | Calcination method | 91.3% (106 mA∙h/g at 100 mA/g, 1000 cycles) | [75] |
| Amorphous FePO4 | SIBs | Calcination method | 87.1% (83.5 mA∙h/g at 100 mA/g, 300 cycles) | [94] |
| Maricite NaFePO4 | SIBs | Electrochemical | 95% (142 mA∙h/g at 0.05C, 200 cycles) | [29] |
| Amorphous NaFePO4 | SIBs | Ball milling | 91.3% (115 mA∙h/g at 1C, 800 cycles) | [30] |
| NaFePO4@C-eCC | SIBs | Electrochemical | 100% (87 mA∙h/g at 10C, 5000 cycles) | [74] |
| Amorphous 1.3NaF-FeSO4 | SIBs | Ball milling | 78% (88 mA∙h/g at 27.4 mA/g, 50 cycles) | [88] |
| NaFe3(SO4)2(OH)6 | SIBs | Electrochemical | About 100% (250 mA∙h/g at 0.05C, 20 cycles) | [95] |
| NaVOPO4@rGO | SIBs | Chemical method | 96% (50 mA∙h/g at 5C, 2000 cycles) | [66] |
| Fe1.13(PO4)(OH)0.39(H2O)0.61 | SIBs | Electrochemical | 90% (101.5 mA∙h/g at 0.1C, 5 cycles) | [26] |
| FeS2/C | SIBs | Electrodeposition | 97.8% (403 mA∙h/g at 100 mA/g, 200 cycles) | [96] |
| Nano-C-Cu2P2O7 | SIBs | Electrochemical | 75% (278 mA∙h/g at 360 mA/g, 300 cycles) | [84] |
| Amorphous Cu(PO3)2 | SIBs | Ball milling | 90% (195 mA∙h/g at 240 mA/g, 100 cycles) | [35] |
| Amorphous VO2 | KIBs | Hydrothermal | 80% (70 mA∙h/g at 500 mA/g, 8500 cycles) | [25] |
| Amorphous FeVO4/C | KIBs | Aqueous precipitation method | About 95% (260.1 mA∙h/g at 300 mA/g, 2000 cycles) | [69] |
| Amorphous FePO4 | KIBs | Coprecipitation | 70% (156 mA∙h/g at 4 mA/g, 50 cycles) | [72] |
| Fe2(MoO4)3 | KIBs | Electrochemical | About 62% (40 mA∙h/g at 1C, 50 cycles) | [98] |
5 总结与展望
本综述重点关注了非晶结构对正极材料电化学性能的影响,非晶正极材料的表征方法和合成策略,并总结了一些代表性的LIBs、SIBs和KIBs用非晶正极材料,特别是钒基非晶正极、铁基磷酸盐非晶正极及各类转换型正极。非晶正极具有高度各向同性的内在结构优势,能够提供更多的离子存储位点和传输路径,其相比于晶态结构具有更好的应变容忍度和均匀的电化学反应性,能够更好地适应体积变化,从而提高电化学性能。尽管近年来非晶正极在储能领域取得了许多进展,但对其储能机制的研究和分析仍不够深入,远不及晶体正极。
目前非晶正极材料多采用高能球磨制备,但所得到的非晶正极形貌不规则、颗粒不均匀且非晶化程度难以控制。现有的合成方法无法有效控制产物的内部精细结构以形成理想的非晶正极,而这种控制对于提高储能性能和实现精确的理论计算至关重要。目前,采用水热法、ALD、PVD、激光熔覆等制备非晶材料的技术在制备正极材料方面应用较少,新的非晶制备工艺可能进一步拓展非晶正极材料的应用。由于原子的配位环境复杂,非晶材料对高能电子的敏感性和对高分辨率的要求,现有的非晶正极的精细表征主要依赖于NMR、TEM、PDF分析、XAS和理论计算,阐明非晶结构对电化学性能的影响仍较为困难。并且,目前对于非晶正极材料界面反应机理的研究较少。未来,随着同步辐射技术、高分辨率成像技术和高级计算方法等先进表征的进一步发展,有望进一步揭示非晶正极的微观结构和储能机理。
为进一步提高非晶正极的电化学性能,碳包覆、构建异质结构和形貌控制、协同嵌入-转换机制等策略被广泛用于非晶正极的设计。但非晶正极材料的开发和研究仍面临诸多挑战,基于非晶材料独特的物理和化学性质,进一步开发低成本、高容量和长循环稳定性的新型碱金属离子电池用非晶正极十分必要。非晶正极材料在储能领域具有巨大的应用潜力,希望该综述能够从碱金属离子电池正极材料的角度加深对非晶材料的思考,推动其在电化学能量存储和转换领域的实际应用。
尚金冰, 孙美玲. 碱金属离子电池非晶正极材料的研究进展[J]. 中国有色金属学报, 2025, 35(1): 78-98. DOI: 10.11817/j.ysxb.1004.0609.2024-45065
SHANG Jinbing, SUN Meiling. Research progress in amorphous cathode materials for alkali metal-ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2025, 35(1): 78-98. DOI: 10.11817/j.ysxb.1004.0609.2024-45065